ITU Kinetika Kimia adalah bidang yang mempelajari faktor-faktor yang mempengaruhi laju perkembangan reaksi kimia, yaitu kecepatan berlangsungnya. Ada semakin banyak penelitian di sekitar area ini, karena kita sering ingin mempercepat beberapa reaksi atau memperlambat reaksi lainnya. Ini sangat penting untuk industri dan penelitian ini memiliki konsekuensi teknologi yang penting.
Tetapi karena kecepatan reaksi dapat bervariasi pada setiap interval waktu dan dari satu zat ke zat lain, biasanya dihitung kecepatan reaksi rata-rata.
Pertimbangkan reaksi umum berikut, di mana koefisien adalah huruf kecil dan reaktan dan produk diwakili oleh huruf besar:
a A + b B → c C + d D
Kecepatan rata-rata reaksi ini akan diberikan membagi laju rata-rata reaksi salah satu zat yang bereaksi atau laju rata-rata pembentukan salah satu produk dengan koefisiennya masing-masing dalam persamaan kimia. Ini diberikan oleh:
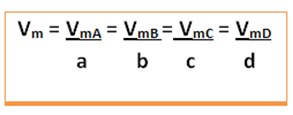
Sebagai contoh, perhatikan reaksi dekomposisi hidrogen peroksida:
2 jam2HAI2 (aq) → 2 H2HAI(1) + 1 O2 (g)
Katakanlah dalam 1 menit 0,3 mol/L H terbentuk2O dan 0,15 mol/L O2, sedangkan 0,3 mol/L H terdekomposisi2HAI2, yaitu, laju rata-rata penguraian dan pembentukan zat-zat ini dalam reaksi adalah:
VmH2O2 = 0,3 mol/L. min
VmH2O = 0,3 mol/L. min
VmO2 = 0,15 mol/L. min
Kecepatan rata-rata reaksi global akan ditemukan dengan mengambil salah satu dari nilai-nilai ini dan membaginya dengan koefisien masing-masing dalam persamaan:
Vsaya = VmH2O2 = 0,3 mol/L. min = 0,15 mol/L. min
2 2
Vsaya = VmH2O = 0,3 mol/L. min = 0,15 mol/L. min
2 2
Vsaya = VmO2 = 0,15 mol/L. min = 0,15 mol/L. min
1 1
Perhatikan bahwa ketiga nilai tersebut sama, oleh karena itu, laju reaksi sama dengan fungsi reaktan atau produk apa pun, dalam interval waktu yang sama.
Namun, bagaimana nilai kecepatan rata-rata dari masing-masing zat yang terlibat dalam reaksi ini ditemukan?
Bisa dihitung membagi variasi konsentrasi zat (reagen atau produk) dengan interval waktu. Jika kita akan menentukan kecepatan rata-rata salah satu dari reagen reaksi, kita harus menempatkan put tanda negatif sebelumnya, atau pertimbangkan nilai konsentrasi dalam modul ||, karena, karena konsentrasi reaktan berkurang dari waktu ke waktu, nilai kecepatan akan negatif, tetapi tidak ada kecepatan negatif.
Jangan berhenti sekarang... Ada lagi setelah iklan ;)

Sebagai contoh, perhatikan reaksi dekomposisi gas ozon berikut (O3 (g)) dalam gas oksigen (O2 (g)):
2 O3 (g) → 3 O2 (g)
Katakanlah dalam sebuah balon terdapat 10 mol gas ozon, tetapi setelah 1 menit, hanya tersisa 4 mol; ini berarti 6 mol ozon berubah menjadi gas oksigen. Jadi kita punya:
2 O3 (g) → 3 O2 (g)
t = 0 menit 2 mol/L 0 mol/L
biaya yang terbentuk
6 mol/L 9 mol/L
t = 1 menit 4 mol/L 9 mol/L
Perhatikan bahwa karena rasio reaksinya adalah 2:3, maka jika 6 mol O digunakan3, 9 mol O terbentuk2. Jadi, setelah 1 menit, kami memiliki kecepatan rata-rata berikut:
Vsaya = - [The3]
untuk
Vsaya = - ([O3 akhir - HAI3 inisial])
untukTerakhir - untukawal
Vsaya = - ([4 - 10])
1– 0
Vsaya = 6 mol/L. min→ Selama 1 menit, 6 mol ozon bereaksi dalam setiap liter sistem.
Vsaya = [The2]
untuk
Vsaya = ([HAI2 akhir - HAI2 inisial])
untukTerakhir - untukawal
Vsaya = ([9 - 0])
1– 0
Vsaya = 9 mol/L. min→ Selama 1 menit, 9 mol oksigen terbentuk di setiap liter sistem.
Ini menunjukkan kepada kita bahwa kita dapat menghitung kecepatan rata-rata sebagai fungsi reaktan atau sebagai fungsi produk.
Sekarang, jika kita ingin menghitung kecepatan rata-rata reaksi global ini, lakukan saja seperti yang kita tunjukkan di awal: bagi masing-masing kecepatan ini dengan koefisiennya masing-masing dalam persamaan kimia:
Vsaya = VmO3 = 6 mol/L. min = 3 mol/L. min
2 21
Vsaya = VmO2 = 9 mol/L. min = 3 mol/L. min
3 3
Vsaya = VmO3 = VmO2
23
Oleh Jennifer Fogaa
Lulus kimia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
FOGAÇA, Jennifer Rocha Vargas. "Kecepatan Reaksi Kimia"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm. Diakses pada 27 Juni 2021.



