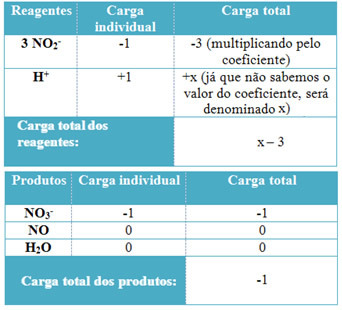
O egyensúlyban tartva az oxidáció-redukció egyenletét a leadott elektronok és a befogadott elektronok számának egyenlőségén alapul. A kiegyensúlyozás egyszerű módját a következő lépések adják:
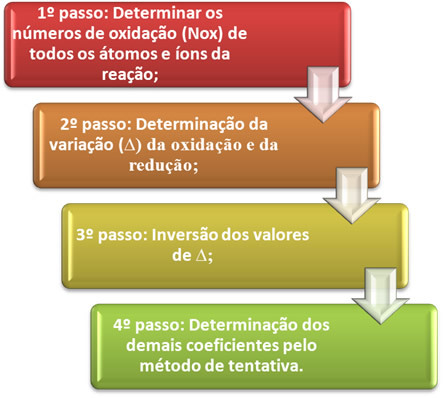
Nézzük meg a gyakorlatban, hogyan kell alkalmazni ezeket a lépéseket a következő példán keresztül:
Reakció vizes kálium-permanganát-oldat és sósav között:
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
*1. lépés:Határozza meg az oxidációs számokat:
Ez a lépés azért fontos, mert általában nem tudjuk gyorsan elképzelni, mely fajok mennek keresztül oxidáción és redukción.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
*2. lépés:Az oxidáció és a redukció változásának meghatározása:

Vegye figyelembe, hogy a mangán (Mn) redukálódik és a klór (Cl) oxidálódik.
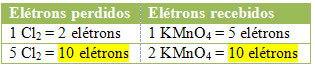
MnCl2 = ∆Nox = 5
Cl2 = ∆Nox = 2
Klór esetében megjegyezhetjük, hogy a HCl 3 vegyületet eredményezett (KCl, MnCl2és Cl2), de ami minket érdekel, az a Cl2, mert a te Noxod változik. Minden klór, amely Cl-t képez2 elveszít 1 elektront; hogy 2 klórra van szükség az egyes Cl-ek kialakításához2, akkor két elektron elvész.
3. lépés:∆ értékek inverziója:
Ebben a lépésben a ∆ értékei kicserélődnek az említett fajok között, ezek együtthatóivá válnak:
MnCl2 = ∆Nox = 5 → 5 lesz a Cl együtthatója2
Cl2 = ∆Nox = 2→ 2 az MnCl együtthatója lesz2
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
Ezen a ponton már meg lehet tudni az egyenlet két együtthatóját.
Megfigyelés: általában a legtöbb reakcióban ezt az értékeket az 1. tagnál hajtják végre. Általános szabályként azonban ezt abban a tagban kell megtenni, amelynek a legtöbb atomja van redoxon. Ha ez a kritérium nem teljesíthető, akkor megfordítjuk az értékeket annak a tagnak az értékeivel, amelynek a legtöbb kémiai faja van. Ezt tették itt, mivel a 2. tag több anyaggal rendelkezik.
Ne álljon meg most... A reklám után még több van;)
4. lépés: Próbaegyensúlyozás:
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Mivel a második tagban két mangánatom van, amint azt az együttható mutatja, az elsőben annak is kell lennie. Tehát:
2 kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Így a kálium (K) mennyisége az 1. tagban 2 volt, amely ugyanolyan együttható lesz a második tagnál erre az atomra:
2 kmnO4 + HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- A klór (Cl) mennyisége a 2. tagban összesen 16, tehát az 1. tag HCl-együtthatója:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- Az 1. tagban lévő hidrogének száma 16, ezért a víz együtthatója (H2A 2. tag O) értéke 8, mivel a (2) hidrogénindex szorzata 8-val egyenlő 16:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
- Két szempontot láthatunk annak ellenőrzéséhez, hogy az egyenlet megfelelően kiegyensúlyozott-e:
1.) Ellenőrizze, hogy az egyes atomok mennyisége a két tagban megegyezik-e:
2 kmnO4 + 16 HCl →2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
K = 2K = 2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
2.) Nézze meg, hogy az elveszett elektronok száma megegyezik-e a befogadott elektronok teljes számával:
Írta: Jennifer Fogaça
Kémia szakon végzett
Hivatkozni szeretne erre a szövegre egy iskolai vagy tudományos munkában? Néz:
FOGAÇA, Jennifer Rocha Vargas. "Roxi-redukció kiegyensúlyozása"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm. Hozzáférés: 2021. június 28.