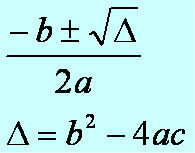Az általunk fogyasztott szódában található gáz szén-dioxid (szén-dioxid - CO2). A hűtőközeget általában egyfajta szirup és ez a gáz vizes oldata képezi. De mielőtt a szirupban kevernék a gázt, a gyártók a vizet és a gázt összekeverik egy karbonizátornak nevezett eszközben, amely szénsavat eredményez, amelynek folyékony formája van. Ebben a fajta italban a következő kémiai egyensúly van:
2 óra2O(1) + 1 CO2. g) ↔ 1 óra3O+(itt) + 1 HCO1-(itt)
Le Chatelier elve azt mondja, hogy amikor valamilyen rendellenességet okoznak egy kémiai rendszerben, egyensúlya elmozdul e zavarok csökkentése felé.
Amikor szódát iszunk, ebben a rendszerben több változás történik, a kémiai egyensúly különböző módon változik.
Például a gyomrunkban van gyomornedv, amelyet főleg sósav (HCl) képez. Ezt a savat, mint minden más, a H-ionok jelenléte jellemzi+ vagy H3O+ vizes közegben. Ezért a sav jelenléte a gyomorban növeli a H koncentrációját3O+ a leírt egyensúlyban, és ennek következtében eltolja a hűtőközeg egyensúlyát a fordított reakcióirányban, a kémiai egyenlet bal oldalára. Ez azt jelenti, hogy nagyobb lesz a szén-dioxid képződése.


Ez az egyik olyan tényező, amely úgynevezett böfögést (böfögést) okoz a szénsavas italok elfogyasztása után.
Egyéb tényezők, amelyek szintén ezt okozzák, a nyomás csökkenése és a hőmérséklet emelkedése. A hűtőközeg gyártásakor a szén-dioxid a folyadékban két körülmény között oldódik: nagyon magas nyomás és alacsony hőmérséklet mellett. Ilyen körülmények között a gáz folyadékká válik, és palackozzák. Ezért hagyja a szóda hidegen a gyárakat.
De amikor a gyomrunkba kerül, a hőmérséklet sokkal magasabb, és a nyomás alacsonyabb. Nézze meg, hogyan befolyásolja ez az egyensúlyt:
- A nyomás csökkenése:
Amikor egy gáznemű rendszer nyomása csökken, az a gáz térfogatának tágulását okozza, és az egyensúly a nagyobb térfogat (nagyobb számú mol) oldalára tolódik. Megjegyezzük, hogy az általunk figyelembe vett egyensúlyban a gáz térfogata nagyobb (a reaktánsok bal oldalán), mivel ez az egyetlen oldal, amely 1 mol szén-dioxidot tartalmaz.
Így a nyomáscsökkenés ezt az egyensúlyt a fordított reakcióirányba tolja el, növelve a CO mennyiségét2 a rendszerben.
- Hőmérséklet-emelkedés:
Mivel a CO oldhatósága2 a vízben a hőmérséklet növekedésével csökken, amikor eléri a gyomrunkat, amelynek hőmérséklete 36 ° C körül van, ez a gáz felszabadul. Így, hasonlóan az előző esetekhez, a fordított reakciót is előnyben részesítik. Az üdítőital fogyasztásakor érzett frissesség érzése a szén-dioxid tágulásából adódik, amely endoterm folyamat, vagyis elnyeli a testünk hőjét.
A nyomás csökkenése és a hőmérséklet emelkedése nemcsak a gyomrunkban következik be. Ezt láthatjuk, amint kinyitjuk a szódásüveget és a nyomás csökkentésekor a gáz felszabadul. Azt is észrevehette, hogy minél melegebb a hűtőközeg, annál több gáz fog kijönni belőle.

Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/equilibrio-quimico-refrigerante-no-estomago.htm