Aozmózis és a oldószer átjáró, kevésbé koncentrált oldattól koncentráltabb oldatig, a félig áteresztő membrán, amíg az oldat által a membránra kifejtett nyomás megakadályozza az oldószer átjutását. Ennek a folyamatnak a célja kiegyensúlyozzuk az oldat koncentrációját.
Olvasd el te is: Oldott anyag és oldószer
ozmotikus nyomás
A ozmotikus nyomás és a nagyobb koncentrációjú oldatra gyakorolt nyomás hogy ozmózis ne következzen be, vagyis hogy az oldószer ne lépje át a féligáteresztő membránt.
Az ozmotikus nyomást a víz sótalanítása, kényszerítve a folyamatot fordított ozmózis, aminek következtében az oldószer a koncentráltabb oldatból a kevésbé koncentrált oldatba kerül. Hívjuk ezt a folyamatot fordított ozmózis. Tekintse meg a következő képet, amely összehasonlítja a két folyamatot:
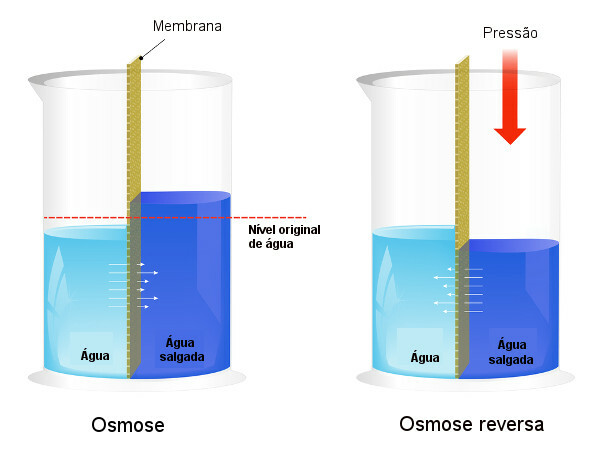
Ne feledje, hogy ozmózisban az oldószer átfolyása a legkoncentráltabb oldat irányába esik, és fordított ozmózisban az átfolyás az alkalmazott nyomás miatt ellentétes irányú. Ha többet szeretne megtudni a témáról, olvassa el a szövegünket:
ozmotikus nyomás.többet tud: Fordított ozmózis a tengervíz sótalanításában
ozmotikus nyomásegyenlet
Oszmotikus nyomás, amelyet a levél képvisel pi (π) A megoldás egyenlete a következő egyenlettel számolható:
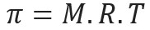
M = koncentráció mol / l-ben
R = a tökéletes gázok univerzális állandója
T = abszolút hőmérséklet, K-ban
mint mások kolligatív tulajdonságok, az ozmotikus nyomás függ a oldatkoncentrációazaz minél nagyobb az oldat koncentrációja, annál nagyobb az ozmózis hatása az oldatokra, és ezért nagyobb az ozmotikus nyomás.
Példák
Az ozmózis mindennapjainkban különböző időpontokban jelenik meg. Példaként említhetjük hús sózási folyamat a te Megőrzés. Ön mikroorganizmusok ami húsromlást okozna elveszíti a vizetbelülről kifelé, amelynek koncentrációja sót tartalmaz, így az étel hosszabb ideig tart.
A só miatt az is előfordul, hogy a egy saláta levelei elhervadnak amiért elveszítette a vizet a belsejükből sejtek (kissé kevésbé koncentrált) a edzett megoldás a külső környezetben.
Az ozmózis akkor is fontos, amikor erről beszélünk vér emberi. Azt mondjuk, hogy a Piros cellák és a vér egy izotóniás közegvagyis ugyanaz az ozmotikus nyomásuk, ami könnyedén lehetővé teszi a víz be- és kilépését a cellából.
Amikor azonban a vér kevésbé koncentrálódik, mint a vörösvértestekben (hipotóniás közeg), a víz átjutása könnyebben bekövetkezik a sejt belsejében, ezáltal kipukkadásig duzzad. Ha a vér koncentrációja nagyobb, mint a vörösvértest (hipertóniás közeg) koncentrációja, akkor a a vérsejtek elszáradnak, mivel elveszítik a vizet.

A húsmegőrzés ugyanazon elvével az gyümölcsmegőrzésaz édességes kompótokban, akik az ételeket megőrzik magas cukorkoncentráció az oldatban.
Az alábbiakban további példák fordulnak elő ozmózis előfordulására:
- a nedv emelkedésében a növény vezető edényeiben;
- nál nél hemodialízis;
- a tápanyagok szelektív átjutásában az emberi test sejtjeiben.
Annak megértéséhez, hogy az ozmózis hogyan történik az állati sejtekben, a növényi sejtekben és más biológiai kérdésekben, olvassa el: Ozmózis: mi ez és hogyan fordul elő az állati és növényi sejtekben.
Írta: Victor Ferreira
Kémia tanár
