A reverzibilis reakciók általában egy bizonyos mennyiségű reagenssel kezdődnek. Amint a közvetlen reakció megkezdődik, idővel ezeket a reagenseket használják fel a képződéshez A reagensek koncentrációja csökken, míg a termékek koncentrációja növekszik. Ezután megindul az inverz reakció is, előállítva a reaktánsokat is, mindaddig, amíg a közvetlen és az inverz reakciók fejlődési sebessége (sebessége) megmarad, elérve az ún. kémiai egyensúly.
Az egyensúlyban van a Kc egyensúlyi állandó, amelyet alapvetően a következő fejez ki:
|
Kc = [Termékek]együttható kiegyensúlyozott kémiai egyenletben [reagensek]együttható kiegyensúlyozott kémiai egyenletben |
Vagyis a következő általános egyensúlyi reakciót figyelembe véve:
a A + b B ↔ c C + d D
Mivel a kisbetűk az együtthatók, a nagybetűk pedig az anyagok, ennek a reakciónak az egyensúlyi állandója a következő lesz:
Kc = [Ç]ç. [D]d
[A]A. [B]B
További részletek erről a szövegben láthatók Kc és Kp egyensúlyi állandók. Ez a szöveg valami fontosat is mutat nekünk: azt, hogy a Kc értékek megmutathatják, hogy a reagensek koncentrációja és a termékek egyenlőek, vagy ha az egyik nagyobb, mint a másik, és ennek következtében, ha a kémiai egyensúly elmozdul a reakció.
Tehát meg kell határoznunk a Kc értékét. Ehhez ne feledje, hogy ezek a számítások kísérleti jellegűek, ezért nézzünk meg néhány példát a reakciókra és az azokból nyert adatokra.
Valami, ami nagyon hasznos a számítások elvégzésében, az az, hogy írjon egy táblázatot, amely hasonló az alábbihoz, és kövesse az abban említett lépéseket:

Táblázat az egyensúlyi állandó kiszámításához használt adatok rendezéséhez
Most menjünk gyakorolni:
1. példa: Zárt tartályban, 2 liter űrtartalommal, 100 ° C hőmérsékleten 20 mol nitrogén van2O4. A következő reverzibilis reakció kezdődik: N2O4 ↔ NEM2. Egy idő után azt tapasztaltuk, hogy a reakció kémiai egyensúlyt ér el, és hogy 8 mol NO2 kialakult. Mekkora a Kc egyensúlyi állandó értéke 100 ° C hőmérsékleten?
Felbontás:
Használjuk a táblázatot:

Az egyensúlyi állandó számítási példa megoldására használt táblázat
Ne feledje, hogy abban a sorban, ahol a reakcióba lépő és kialakuló mennyiségeket írták, tudjuk, hogy 4 mol N-ot költöttek el2O4, mert az arány 1: 2, és 8 mol NO képződött2.
Most csak cserélje le a reakció Kc egyensúlyi állandójának kifejezésében talált értékeket:
Kc = [A2]2
[N2O4]
Kc = (4 mol / l) 2
(8 mol / L)
Kc = 2 mol / l
A Kc értéke dimenzió nélküli, semmilyen nagyságrenddel nem függ össze.
Most nézzünk meg egy példát, amely a kezdetektől fogva termékeket is tartalmaz:
2. példa: Egy 5 liter űrtartalmú zárt tartályban, T hőmérsékleten 2 mol hidrogéngáz, 3 mol jódgáz és 4 mol hidrogén-jodid van. A reakció kémiai egyensúlyba kerül, T hőmérsékleten, és kiderül, hogy az edényben 1 mol hidrogéngáz van. Mi az ezt az egyensúlyt ábrázoló grafikon és mekkora a Kc egyensúlyi állandó értéke T hőmérsékletén?
Felbontás:
A táblázat használata:
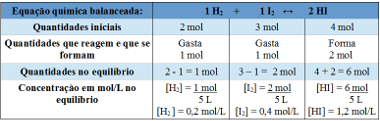
Az egyensúlyi állandó meghatározására használt táblázat
A reagensek és termékek mol / L koncentrációjának változásait az egyensúly eléréséig bemutató grafikon a következő módon adható meg:

A reagensek és termékek koncentrációjának változását mutató kémiai egyensúlyi grafikon
Most felfedezzük az egyensúlyi állandó értékét:
Kc = __ [HI]2__
[H2 ]. [ÉN2]
Kc = (1,2)2
0,2. 0,4
Kc = 18
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm
