A karbonátok olyan szervetlen vegyületek, amelyek egy fém vagy félmetál ionos kötésével jönnek létre a karbonátanionnal, a CO32-.
A szén négyértékű, vagyis négy elektronja van a vegyértékhéjban, és négy kovalens kötést képes stabilá tenni, míg az oxigén kétértékű, hat elektron van a vegyértékhéjban, és két kötést képes stabilá tenni, nyolc elektronok. Tehát erős a tendencia, hogy a szén két oxigénatomhoz kötődik, amelyek mindegyike stabil (O ═ C ═ O → CO2).
De más oxigén kombinálható a szénnel, mivel az ionsugarak aránya 3-as koordinációs számhoz vezet, és így struktúrát alkot háromszög alakú, amelyben a szén a középpontban helyezkedik el, kettős kötést kötve az egyik oxigénatommal és két egyszeres kötéssel a másik kettővel oxigének. Az eredmény két elektronfelesleg, mivel ez a két oxigén nem stabil, egy-egy elektront kell kapniuk:
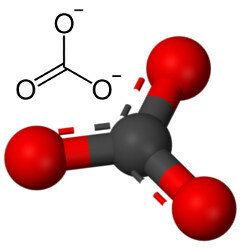
A karbonátaniont kovalens kötések alkotják, vegyületei azonban szervetlen sók és ásványi anyagok a karbonátok néven ionosak, mivel ez a gyök két elektront vesz fel valamilyen fémből vagy félmetálból, így a ionos kötés.
Ezek a vegyületek vízben nem oldódnak, az ammónium-karbonát ((NH4)2CO3) és alkálifémekkel képzett karbonátok (az 1. család elemei: Li, Na, K, Rb, Cs és Fr). Szinte mindegyik fehér szilárd anyag, amint az az alábbi képen látható:

A karbonátok két leggyakoribb és legfontosabb mindennapi példája a nátrium-karbonát (Na2CO3) és kalcium-karbonát (CaCO3). Az első esetben a nátrium az 1. családba tartozik, amelynek elektronja a vegyértékhéjban van, és hajlamos elveszíteni ezt az elektront, hogy stabilizálódjon. Mivel a karbonátanionnak két elektron befogadására van szüksége, két nátriumatomhoz kötődik:

A szóda hamu ismertebb nevén szóda vagy szóda, amelyet szappanok, színezékek, gyógyszerek, papírok gyártásához és az uszodavíz kezeléséhez használnak. De az üveggyártás fő alkalmazási területe a kalcium-karbonát és a homok.
A kalcium a 2. család, két elektron elvesztésére hajlamos. Így egy kalcium atom kötődik egy karbonát gyökhöz:

A kalcium-karbonát a mészkőben és a márványban van jelen. Nál nél cseppkövek és sztalagmitok amelyek a barlangokban léteznek, ebből a karbonátból állnak; kagyló, korallzátonyok és tojáshéjak is. Amikor falakat, fatörzseket és más helyeket meszelünk, kalcium-hidroxidot (Ca (OH)2), amely idővel a légköri szén-dioxiddal reagálva kalcium-karbonátot képez.

A karbonátok nagyon gyakoriak a föld felszínén, mint az ásványi anyagok esetében. Kristályos retikuluma kétféleképpen képes átrendeződni az űrben: az ortorombos (mint a fent bemutatott ásványi aragonit és a kalcium-karbonát képlet együtt) és a romboéderes vagy trigonális, akárcsak a kalcit (egy másik ásvány, amely kalcium-karbonátból áll).
A karbonátok savak jelenlétében reagálva CO-t szabadítanak fel2, amely könnyen látható egy pezsgésen keresztül.
Írta: Jennifer Fogaça
Kémia szakon végzett