O Le Chatelier elve azt mondja nekünk, hogy ha egy rendellenességet okoznak egy egyensúlyi rendszerben, akkor az abba az irányba tolódik el, amely minimalizálja a zavar által létrehozott erőket, és helyreállítja az új kémiai egyensúlyt.
E zavarok egyike a hőmérsékletváltozás. Ez a variáció azért fontos, mert amellett, hogy az egyensúlyi elmozdulást kiváltja, megváltoztatja az egyensúlyi állandó értékét, Kç.
Annak érdekében, hogy jobban megértsd, hogyan történik ez, nézzünk meg egy példát:
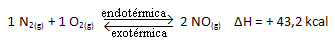
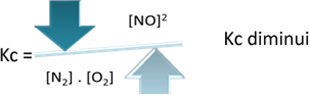
Kç = _ [AT]2___
[N2]. [O2]
A fenti reakció energiafelvétel mellett közvetlen irányban megy végbe, endoterm. A fordított folyamat viszont az energia felszabadulásával megy végbe, exoterm reakció.
Tehát, ha növeljük a rendszer hőmérsékletét, a kémiai egyensúly elmozdul az endoterm reakció felé, ami ebben a reakcióban jobbra helyezkedik el. Ennek az az oka, hogy a hő elnyelődjön, és helyreálljon az egyensúly.
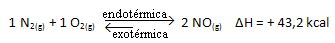
Az ellenkezője is igaz; ha csökkentjük ennek a rendszernek a hőmérsékletét, a reakció abba az irányba tolódik el, hogy hőt bocsásson ki, mert a reakció teljes energiája csökken. Ez azt jelenti, hogy az egyensúly elmozdul az exoterm reakció felé, amely ebben az esetben balra helyezkedik el:
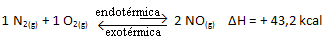
Röviden:

Az egyensúlyi állandóval (Kç), amikor a hőmérséklet emelkedik, ez kedvez az endoterm reakciónak és több NO-nakg) képződik, növelve annak koncentrációját és csökkentve a reagensek koncentrációját. Az alábbi képletben vegye figyelembe, hogy az NO koncentrációg) egyenesen arányos a K állandóvalçezért növekszik:
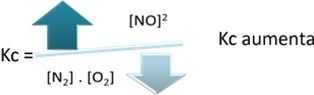
De ha csökkentjük a hőmérsékletet, a reakciót az exoterm reakció felé toljuk, akkor a NO termék koncentrációja csökken, és a reagensek koncentrációja nő. Mivel a reagensek koncentrációi fordítottan arányosak a Kc állandóval, akkor csökken:
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/variacao-temperatura-deslocamento-equilibrio-quimico.htm

