Egyensúlytermikus az az állapot, amelyben egy test a azonoshőfok mint a környezetük. Megfigyelték, hogy minden test, amely magasabb hőmérsékleten van, mint a szomszédja, hajlamos spontán hőt adni nekik, amíg mindkettő nem kezd azonos hőmérsékletet felmutatni.
Nézis:A termológia alapjai
Termikus egyensúly és a termodinamika nulla törvénye
A termodinamika nulla törvényének hátterében a termikus egyensúly áll. Ez a törvény megállapítja, hogy abban az esetben, ha két termodinamikai rendszer, A és B, termikus egyensúlyban vannak egy harmadik termodinamikai rendszerrel, Ç, azután, A és B termikus egyensúlyban is lesznek.
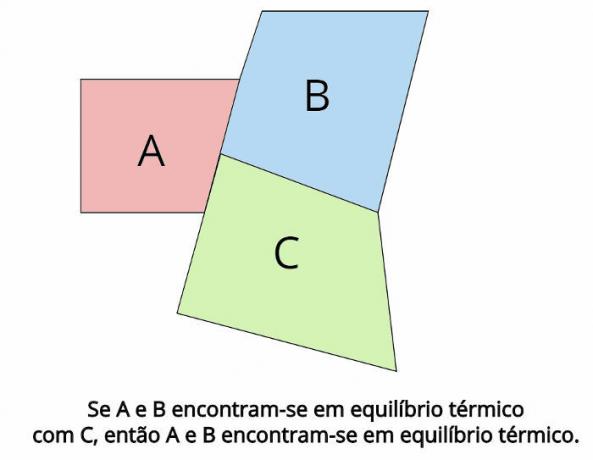
Termikus egyensúlyban az egyes testek véghőmérsékletének meg kell egyeznie: TA = TB = TÇ
Nézze meg, mit állapít meg a termodinamika nulla törvényének állítása:
“Ha két test hőháztartásban van egy harmadik testtel, akkor ezek a testek hőegyensúlyban vannak egymással. "
A termikus egyensúly megértésének másik módja a testek belső energiáján alapul. A belső energia, vagy egyszerűen csak a hőenergia fizikai mennyiség
közvetlenülarányos à hőfok a test. Ezért, ha ugyanazon termodinamikai rendszeren belül különböző hőmérsékletű testek vannak, akkor azok különböző moduljaival rendelkeznek belső energiát, és ezért az energia egy részét át fogja adni egymás között, amíg nincs különbség az energiáik között. belső. Szeretne többet megtudni arról, hogy mi a belső energia és milyen tulajdonságokkal rendelkezik? Hozzáférés a cikkhez: Belső energia.Ne álljon meg most... A reklám után még több van;)
hő- és hőegyensúly
A hőátadás mindig spontán történik, a legmagasabb hőmérsékletű testtől a legalacsonyabb hőmérsékletű testig. Ez az energia hő formájában történő átvitel olyan folyamatokon keresztül történhet, mint pl vezetés, konvekció és sugárzás.
Vezetés: A testek közötti hőátadás elsősorban a szilárd anyagokban fordul elő. Ebben a típusú vezetésben tömeges transzferek nem fordulnak elő. Ez a típusú hőátadás megmagyarázza, hogy a hőegyensúly hogyan fordul elő például a fémekben.
Konvekció: Ez egy hőátadás, amely folyadékokban megy végbe. Ebben a hőátadási módban tömegátadás történik, miközben a fűtött folyadék mozog, konvekciós áramokat képezve, amíg az összes folyadék el nem éri a hőegyensúlyt.
Sugárzás: Ez a hő elektromágneses hullámokon keresztül történő továbbítása, tehát ez a folyamat akkor is bekövetkezik, ha a test és egy másik test között különböző hőmérsékleten nincs fizikai közeg. Az átadott hő ebben az esetben egyenértékű az elektromágneses hullámokkal, kevesebb energiával, mint látható fény, tehát hősugárzás, amely a infravörös.
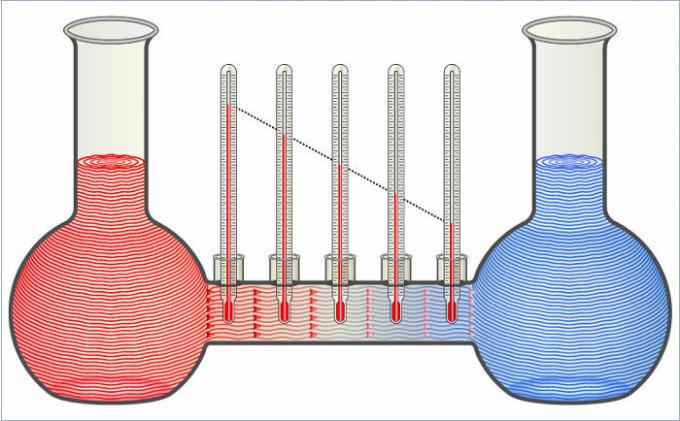
Az ábrán látható két folyadék hőt ad át egymásnak, amíg a hőmérsékletük meg nem egyezik.
Szeretne többet tudni arról, hogy az egyes hőátadási folyamatok hogyan zajlanak le? Hozzáférés a cikkhez: Hőterjedési folyamatok.
érzékelhető hő
amikor van különbségban benhőfok két test között, vagy egy test és környezete között spontán hőcsere lesz közöttük, így a a magasabb hőmérsékletű test lehűl, és az alacsonyabb hőmérsékletű testek addig melegednek, amíg mind el nem érik a hőmérsékletet ban ben egyensúlytermikus.
Azt a hőmennyiséget nevezzük, amelyet a testek különböző hőmérsékleten cserélnek érzékelhető hő és ez az összeg kiszámítható az alábbi ábrán látható képlettel:
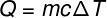
Q - hő (mész vagy J)
m - tömeg (g vagy kg)
ç - fajlagos hő (cal / gºC vagy J / kg). K)
ΔT - hőmérséklet-változás (° C vagy K)
A fent bemutatott képletben fontos kiemelni a név nagyságát fajlagos hő. ilyen nagyságrendben méri a az a tömeg / tömeg energiamennyiség, amelyre az anyagnak szüksége van ahhoz, hogy kinyerje vagy elnyelje a hőmérsékletét 1 ° C-kal. Például tiszta víz esetén, normál nyomáson, hőmérsékletének 1 ° C-os változtatásához minden egyes gramm vízhez 1,0 kalória szükséges.
Így minden olyan anyag, amely termikus kapcsolatot létesített egymással, hajlamos elérni az állapotát egyensúlytermikus idővel spontán módon azonban egyesek nagyobb energiát igényelnek ehhez, és ez közvetlenül befolyásolja a hőmérsékletet a hőegyensúly eléréséhez.
olvasis:Mi a hőmérséklet?
látens hő
Lehetséges, hogy a környezettel folytatott hőcserék során a test olyan nyomást, hőmérsékletet és térfogatot mutat, amely megváltoztatja fizikai állapotát. Ezek a változások a hőfokállandó (egyetlen anyagból álló testek esetében, szennyeződések nélkül), vagyis annak ellenére, hogy hőt kap vagy ad a külső környezetnek, ezen testek hőmérséklete nem változik.
Ez csak azért lehetséges, mert ebben az esetben az összes kicserélt energiát felhasználják molekuláinak konformációjának megváltoztatására. Attól a pillanattól kezdve, hogy az energiagátat "legyőzik", és a test összes tartalma egy másik fizikai állapotban van, a A test továbbra is hőcserét folytat a környezetével, kivéve, ha a hőmérséklete természetesen megegyezik a kinti hőmérséklettel.
O látens hő az alábbi ábrán látható képlettel kiszámítható, ellenőrizze:
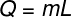
Q - látens hő (mész vagy J)
m - tömeg (g vagy kg)
L - fajlagos látens hő (cal / g vagy J / kg)
Termikus egyensúlyi képlet
Abban az esetben, ha meg akarjuk tudni, mi az hőfokban benegyensúly valamilyen termodinamikai rendszer esetében szükséges, hogy a kérdéses rendszert a rendszerizoláltvagyis azt kell feltételeznünk, hogy a rendszer szomszédjaival semmiféle hő nem cserélődik ki.
Ebből az állapotból azt mondhatjuk, hogy a teljes hőcserét csak az ezt a rendszert alkotó testek cserélik ki, figyelmen kívül hagyva a hőveszteségeket például a tartály falaihoz. Ebben az esetben azt mondjuk, hogy a konténernek van hőteljesítmény elhanyagolható, azaz nem szív fel semmilyen hőt.
Képzelje el a következő helyzetet: egy csésze forró teában, elhanyagolható hőkapacitással öntsön néhány jégkockát. A termikus egyensúlyi hőmérséklet meghatározásához a rendszer kezdeti feltételeinek ismerete mellett néhány szempontot is meg kell tennünk:
A forró tea által a jégnek adott hőmennyiséget teljes mértékben elnyeli, mivel a csésze elenyésző hőkapacitással rendelkezik.
Nem szabad figyelmen kívül hagynunk a levegő és más környezet hőveszteségét, hogy ez a csésze tea zárt termodinamikai rendszerként értelmezhető legyen.
Ily módon megállapíthatjuk, hogy a jég által kapott teljes hőmennyiséget feladta a forró tea, ezzel megírtuk a hőmérleg kiszámításának képletét:
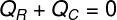
QR - Hő érkezett
QÇ - adott hő
A (QÇ) arra a hőmennyiségre vonatkozik, amelyet a forró tea átvitt a benne elhelyezett jégkockákba. Már a kapott hő (QR) a jégkockák által kapott hőmennyiség. Ennek a hőmennyiségnek két természete lesz: hő érzékeny és forró rejtett, mivel a hőegyensúly elérése érdekében a jégkockák valószínűleg megolvadnak.
A hőegyensúly hőmérsékletének meghatározása
Határozzuk meg a hőegyensúly hőmérsékletét a következő helyzet alapján:
Egy elhanyagolható hőkapacitású csésze, amely 200 ml (200 g) teát tartalmaz 70 ° C kezdeti hőmérsékleten, 10 g jeget kap -10 ° C hőmérsékleten. Határozza meg a rendszer hőegyensúlyi hőmérsékletét (feltételezzük, hogy a tea fajlagos hője megegyezik a víz fajhőjével):
Adat:
çVÍZ = 1,0 cal / g ° C
çJÉG = 0,5 cal / g ° C
LJÉG = 80 cal / g
Először azt vesszük figyelembe, hogy a jég által kapott összes hőt a tea adta át:

Ezután részletezni kell, hogy mely hőformákat adták és kapták:
Tea: A tea csak érzékeny hőt adott (Qs), mivel fizikai állapota nem változott.
Jég: A jég kezdetben -10 ° C-on volt, ezért érzékeny hőt kapott (Qs) 0 ° C hőmérsékletig, majd látens hőt kapott (QL) cseppfolyósítani. Miután folyékony lett, látens hőt kapott (Qs), amíg a hőegyensúlyba nem kerül (TF) teával.
A fent elemzetteket egyenlet formájában lefordítva a következő számítást kell megoldanunk:
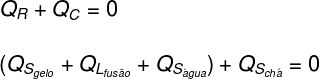
A gyakorlatban megadott adatok felváltásával a fenti egyenletbe a következő számítást kell megoldanunk:
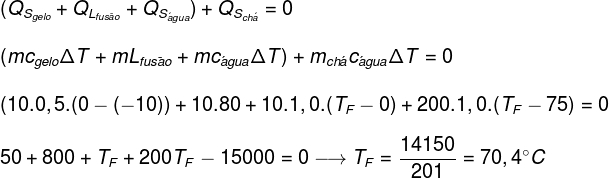
A fenti számítás szerint a tea + jég rendszer egyensúlyi hőmérsékletének körülbelül 70,4 ° C-nak kell lennie.
Hőmérleg-kísérlet
Két test közötti hőegyensúly tesztelésére több kísérletet is elvégezhetünk. Ezek közül a legegyszerűbb azonban a hőmennyiségmérő ez egy hőmérő. A kaloriméter egy adiabatikus tartály (amely nem teszi lehetővé a hő átadását), hőkapacitással ról rőlelhanyagolható, mint például egy hungarocellel bélelt edény, amely jó hőszigetelő.

A kalorimétert a rendszer hőmérséklet-változásának mérésére használják.
Termikus egyensúly és élet a Földön
O egyensúlytermikus alapvető szerepet játszik a földi életben. Az üvegházhatású gázok jelenléte nélkül a Föld légkörében a hősugárzás a bolygó elhagyja, terjedve az űrbe. Idővel ez hatalmas hűlést okozna a bolygón, ami az óceánok idővel lefagyását okozná.
Ezenkívül az óceánok kulcsszerepet játszanak a egyensúlytermikus a bolygó. A nagyszerűsége miatt tészta és hőkülönleges, az óceánok hatalmasakkal vannak ellátva kapacitástermikus, vagyis a hőmérsékletük megváltoztatásához hatalmas mennyiségű hőt kell kapniuk. Emiatt nagyon hatékonyan képesek szabályozni a bolygó hőmérsékletét. Az óceántól távol eső, kevés vízzel rendelkező régiók általában nagyok termikus tartományok, mint a sivatagok esetében, amelyek nappal rendkívül forróak és éjszaka fagyosak.
Ezért a egyensúlytermikus ez egy alapvető fontosságú folyamat a bolygón a fizikai, kémiai és biológiai folyamatok fenntartása szempontjából, ezért elengedhetetlen a földi élet létezéséhez.
Általam. Rafael Helerbrock


