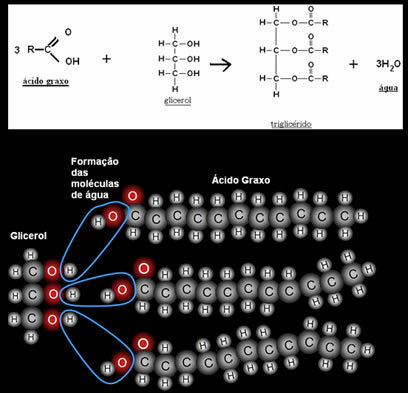
A szerves vegyületek molekulárisak, vagyis atomjaik kovalens kötéseket hordoznak egymással. Amikor elemezzük a szénatomok közötti kötéseket, amelyek lehetnek egyszeresek, kettősek vagy hármasak, megfigyelhetjük, hogy azok vannak nem poláris kötések, mivel az atomok között nincs különbség az elektronegativitásban, mivel ezek azonosak elem.
Továbbá, mivel a hidrogénnek és a szénnek nagyon kicsi az elektronegativitási különbsége, a közöttük lévő kötések szintén nem polárosak.
Nem poláris csatlakozások:
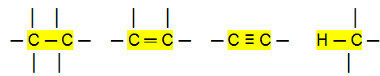
Ezzel arra következtethetünk, hogy a Szénhidrogének (szerves vegyületek, amelyek csak szén- és hidrogénatomot tartalmaznak) nem poláros molekulák. Ezekben a vegyületekben az intermolekuláris interakció indukált dipól típusú, amely a leggyengébb, ami létezik.
Mivel gyengék, ezeket az interakciókat könnyű megszakítani. Ennek köszönhetően, a szénhidrogének forrás- és olvadási hőmérséklete alacsonyabb, mint más funkcióké.

A szénhidrogének összehasonlítása, a forráspontok növekedni fognak a moláris tömeg növekedésével is.
Például az etán és a bután egyaránt alkán. Lásd az egyes kísérletileg meghatározott forráspontokat:
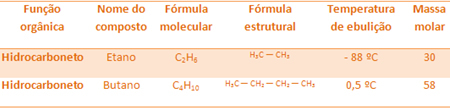
Vegye figyelembe, hogy a bután forráspontja sokkal magasabb, mint az etáné, mivel moláris tömege is nagyobb.
Most, amikor összehasonlítjuk az azonos moláris tömegű szénhidrogéneket (ezek izomerek), de különböző típusú szénláncokkal rendelkeznek, rájövünk, hogy minél nagyobb az elágazások száma, annál alacsonyabb a forráspont, mert a molekula szerkezete tömörebbé válik, vagyis felülete csökken.
Ne álljon meg most... A reklám után még több van;)
Az összes alábbi alkán molekula képlete azonos, C5H12, de forráspontjuk eltérő:
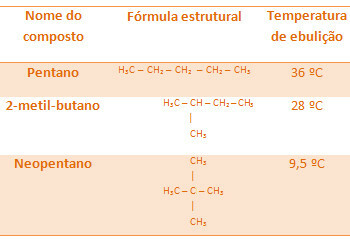
Vegye figyelembe, hogy a neopentán forráspontja a legalacsonyabb, mivel több elágazása van.
Megfontolhatjuk, hogy a többi szerves funkció szénhidrogénekből származik, egy vagy több hidrogén atomokkal vagy más elemek atomcsoportjaival történő helyettesítésén keresztül. Általában a többi szerves funkció oxigénnel vagy nitrogénnel rendelkezik, amelyek inkább elektronegatív elemek, mint a szén. Erősebben vonzzák a szénnel megosztott elektronpárt, és ezért a molekulát polárossá teszik:
Poláris csatlakozások:
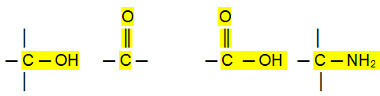
Az aldehidek, ketonok és szerves halogenidek forráspontja magasabb, mint szénhidrogének, mert intermolekuláris kölcsönhatásuk az állandó dipól, amely erősebb, mint a indukált dipólus.
Az alkoholok, a karbonsavak és az aminok viszont még magasabb forráspontúak, mivel hidrogénkötéseket hajtanak végre, ami az intenzívebb molekulák közötti interakció.
Az összes ilyen funkcióval rendelkező vegyületekre ugyanaz vonatkozik, mint a szénhidrogénekre:

Írta: Jennifer Fogaça
Kémia szakon végzett
Hivatkozni szeretne erre a szövegre egy iskolai vagy tudományos munkában? Néz:
FOGAÇA, Jennifer Rocha Vargas. "Szerves vegyületek polaritása és forráspontja"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/quimica/polaridade-temperatura-ebulicao-dos-compostos-organicos.htm. Hozzáférés: 2021. június 28.