
Néha előfordulhat minimális képlet azonosak legyenek a vegyület molekulaképletével; ez azonban nem mindig igaz.
Például a víz empirikus vagy minimális képlete H2O, jelezve, hogy a vízmolekulákat alkotó elemek között 2: 1 arány van. És véletlenül ez a víz molekuláris képlete is. Ha azonban látni szeretné, hogy ez nem mindig történik meg, nézze meg az alábbi két példát:
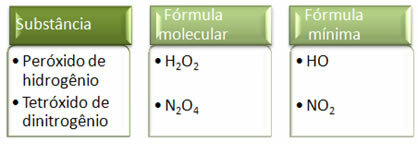
Mivel a minimális képlet csak az egyes elemek atomjainak aránya, és nem a tényleges mennyiségük a molekulaképletben, előfordulhat Különböző vegyületek, amelyeknek ugyanaz az empirikus képlete és még egy vegyület minimális képlete is megegyezhet a (I) általános képletű vegyületekkel Egyéb. Ne feledje, hogy az alábbi példában ez megtörténhet:
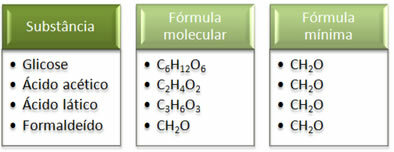
Lásd, hogy a minimális képlet CH2Ez minden anyagra megegyezik, vagyis ez a minimális képlet azt fejezi ki, hogy minden esetben a szén-, hidrogén- és oxigénatomok a molekulaképletekben kb 1:2:1. Továbbá az egyetlen, amelynek molekuláris képlete megegyezik az empirikus formulával, az a formaldehid.
- A minimális vagy az empirikus képlet kiszámítása:
A vegyületek empirikus képletének meghatározásához először meg kell tudni, hogy mekkora a százalékos vagy közeli képlete. Ezt úgy tehetjük meg, hogy az egyes elemek tömegét megmérjük 100 g mintában. A szöveg "Százalékos vagy centezimális képlet”Tisztázza ezt az ügyet jobban.
Ne álljon meg most... A reklám után még több van;)
Tegyük fel például, hogy egy adott vegyület közeli összetételét a 40,00% C, 6,67% H és 53,33% O adja. Ezeket az értékeket grammokra adjuk át, figyelembe véve a 100 g összetett minta tömegét. Így van: 40 g C, 6,67 g H és 53,33 g O.
Most ezeket az értékeket át kell adni az anyag mennyiségének (mol). Ezt úgy végezzük, hogy az egyes talált értékeket elosztjuk moláris tömegükkel:
C: 40/12 = 3,33
H: 6,67 / 1 = 6,67
O: 53,33 / 16 = 3,33
Mivel az értékek nem egész számok, a következő eszközt használjuk: az összes értéket elosztjuk a legkisebbel, így a köztük lévő arány nem változik.
Ebben az esetben a legkisebb érték 3,33, így az eredmény:
C: 3,33 / 3,33 = 1
H: 6,67 / 3,33 = 2
O: 3,33 / 3,33 = 1
Így ennek az ismeretlen anyagnak a minimális képlete megegyezik: Ç1H2O1 vagy CH2O.
Röviden: az anyag empirikus vagy minimális képletének megtalálásához szükséges lépések a következők:

Írta: Jennifer Fogaça
Kémia szakon végzett
Hivatkozni szeretne erre a szövegre egy iskolai vagy tudományos munkában? Néz:
FOGAÇA, Jennifer Rocha Vargas. "Minimális vagy empirikus képlet"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm. Hozzáférés: 2021. június 28.



