Reakcije halogeniranja vrsta su organske supstitucijske reakcije, odnosno one u kojoj a atom ili skupine atoma zamjenjuju se atomima ili skupinama atoma druge molekule organski.
Općenito se ova vrsta reakcije odvija s alkanima i aromatskim ugljikovodicima (benzen i njegovi derivati).
Halogeniranje se naziva tako jer se događa s jednostavnim tvarima halogena: F2, Cl2, br2 Hej2. Međutim, najčešće su među njima kloriranje (Cl2) i bromiranje (Br2), jer je fluor vrlo reaktivan, a njegove reakcije su eksplozivne i teško se kontroliraju, čak uništavajući organske tvari:
CH4 (g) + 2 F2 (g) → C(s) + 4HF(g)
Reakcije s jodom su izuzetno spore.
Ispod su glavne vrste halogeniranja i neki primjeri:
1. Halogeniranje alkanima: Budući da su alkani slabo reaktivni, njihove reakcije halogeniranja odvijaju se samo u prisutnosti sunčeve svjetlosti (λ), ultraljubičastog svjetla ili jakog zagrijavanja. Ova vrsta reakcije provodi se radi dobivanja alkil halogenida.
Primjer: monokloriranje metana:
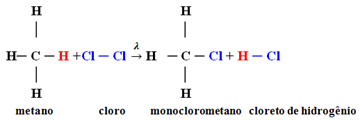
U ovom je slučaju nastao iz atoma vodika metana (CH
4) zamijeniti atomom klora, dajući monoklorometan. Ako je bilo previše klora, ova bi se reakcija mogla nastaviti obrađivati, zamjenjujući sve vodikove u metanu.1.1. Halogeniranje u alkanima s više od 3 ugljika: Ako alkan koji treba reagirati ima najmanje 3 atoma ugljika, na kraju imamo smjesu različitih supstituiranih spojeva. Pogledajte donji primjer monokloriranja metilbutana:
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
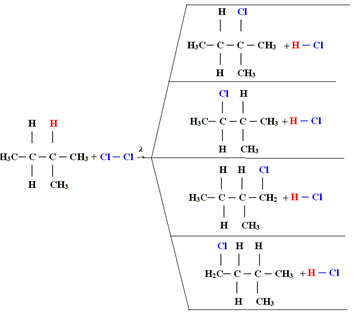
Količina svakog spoja bit će proporcionalna sljedećem redoslijedu lakoće s kojim se vodik otpušta u molekulu:

Dakle, u slučaju gore, najveća količina bit će 2-metil-2-klorobutan, a najmanja količina 2-metil-1-klorobutan.
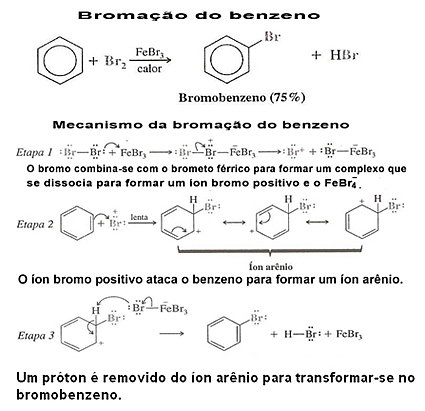
2. Halogeniranje benzena: Benzen normalno ne reagira s klorom ili bromom. Međutim, ako se Lewisova kiselina koristi kao katalizator (obično se koristi FeCl3, FeBr3 ili AlCl3, svi u bezvodnom obliku), benzen lako reagira u reakciji halogeniranja.
Klorid i željezni bromid mogu se dobiti dodavanjem željeza u smjesu i na taj način on reagira s halogenom i stvara Lewisovu kiselinu:
2 Fe + 3 Br2 → 2 febr3
Pogledajte primjer halogeniranja benzena i njegov mehanizam:
3. Halogenizacija derivata benzena:U takvim slučajevima supstitucija se vodi supstituentom ili funkcionalnom skupinom koja je vezana za aromatsku jezgru. Da biste vidjeli kako se to događa, pročitajte tekstove "Upravljajući radikali u benzenskom prstenu"i"Elektronički učinci radikala meta i orto-režisera”.
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Reakcije organskog halogeniranja"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/reacoes-organicas-halogenacao.htm. Pristupljeno 28. lipnja 2021.