Grafen je nanomaterijal sastavljen samo od ugljika, u kojem se atomi povezuju tvoreći heksagonalne strukture.
To je najfiniji poznati kristal, a njegova ga svojstva čine vrlo poželjnim. Ovaj je materijal lagan, elektroprovodljiv, krut i vodonepropusan.
Primjenjivost grafena je na nekoliko područja. Najpoznatija su: građevinarstvo, energetika, telekomunikacije, medicina i elektronika.
Otkako je otkriven, grafen ostaje u središtu istraživačkog interesa. Proučavanje aplikacija za ovaj materijal mobilizira institucije i ulaganja od milijuna eura. Dakle, znanstvenici širom svijeta neprestano pokušavaju razviti jeftiniji način velike proizvodnje.
Razumijevanje što je grafen
Grafen je alotropni oblik ugljika, gdje raspored atoma ovog elementa tvori tanak sloj.
Ovaj alotrop je dvodimenzionalan, odnosno ima samo dva mjerenja: širinu i visinu.
Da bismo dobili ideju o veličini ovog materijala, debljina lista papira odgovara superpoziciji 3 milijuna slojeva grafena.
Iako je riječ o najtanjem materijalu koji je čovjek izolirao i identificirao, njegova dimenzija je reda nanometra. Lagan je i jak, sposoban provoditi električnu energiju bolje od metala poput bakra i silicija.
Raspored koji atomi ugljika zauzimaju u strukturi grafena čini da se u njemu mogu naći vrlo zanimljive i poželjne karakteristike.
Primjene grafena
Mnoge tvrtke i istraživačke skupine širom svijeta objavljuju rezultate rada koji uključuje aplikacije za grafen. Pogledajte ispod glavne.
| Voda za piće | Opne oblikovane grafenom sposobne su za desalinizaciju i pročišćavanje morske vode. |
|---|---|
| Emisije CO2 | Grafenski filtri mogu smanjiti emisiju CO2 odvajanjem plinova koje generiraju industrije i tvrtke koji će biti odbačeni. |
| otkrivanje bolesti | Mnogo brži biomedicinski senzori temelje se na grafenu i mogu otkriti bolesti, viruse i druge toksine. |
| Građevinarstvo | Građevinski materijali poput betona i aluminija čine se lakšim i čvršćim dodavanjem grafena. |
| Ljepota | Bojanje kose prskanjem grafenom, čije bi trajanje bilo oko 30 pranja. |
| Mikrouređaji | Čipovi još manji i jači zbog zamjene silicija grafenom. |
| Energija | Solarne ćelije imaju bolju fleksibilnost, veću transparentnost i niže troškove proizvodnje uz upotrebu grafena. |
| Elektronika | Baterije s boljim i bržim skladištenjem energije mogu se napuniti do 15 minuta. |
| Mobilnost | Bicikli mogu imati čvršće gume i okvire teške 350 grama pomoću grafena. |
Graphene Struktura
Strukturu grafena čini mreža ugljika povezanih u šesterokute.
Jezgra ugljika sastoji se od 6 protona i 6 neutrona. 6 elektrona atoma raspoređeno je u dva sloja.
Na valentni sloj postoje 4 elektrona, a ova ljuska drži do 8. Stoga, da bi ugljik stekao stabilnost, mora uspostaviti 4 veze i postići elektroničku konfiguraciju plemenitog plina, kako je navedeno u pravilu okteta.
Atomi u grafenu vezuju se pomoću kovalentne veze, odnosno postoji dijeljenje elektrona.

Ugljik-ugljik veze su najjače veze koje se nalaze u prirodi i svaki ugljik pridružuje se ostalim 3 u strukturi. Stoga je hibridizacija atoma sp2, što odgovara 2 jednostruke i jednoj dvostrukoj vezi.
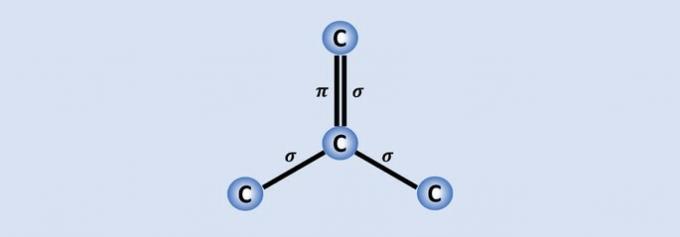
Od 4 ugljična elektrona, tri se dijele sa susjednim atomima, a jedan koji čini vezu. , pomaže grafenu, na primjer, da bude dobar provodnik električne energije jer ima više "slobode" u materijalu.
Svojstva grafena

| Svjetlo | Kvadratni metar težak je samo 0,77 miligrama. Grafenski aerogel je oko 12 puta lakši od zraka. |
|---|---|
| Fleksibilno | Može se proširiti do 25% svoje duljine. |
| Dirigent | Njegova gustoća struje veća je od bakra. |
| Izdržljiv | Hladno se širi, a toplina skuplja. Većina tvari djeluje suprotno. |
| Vodootporan | Mreža koju čine ugljici ne dopušta ni prolazak atoma helija. |
| Otporan | Otprilike 200 puta jači od čelika. |
| Prozirna | Apsorbira samo 2,3% svjetlosti. |
| Tanak | Milijun puta tanji od ljudske kose. Njegova debljina je samo jedan atom. |
| Teško | Poznat je najtvrđi materijal, čak i više od dijamanta. |
Povijest i otkriće grafena
Pojam grafen prvi se put upotrijebio 1987. godine, ali službeno je priznat tek 1994. godine od strane União de Química Pure and Applied.
Ova je oznaka nastala na spoju grada grafit sufiksom -ene, koji se odnosi na dvostruku vezu tvari.
Od pedesetih godina 20. stoljeća Linus Pauling je u svojim predavanjima govorio o postojanju tankog sloja ugljika, koji se sastoji od šesterokutnih prstenova. Philip Russell Wallace također je godinama ranije opisao neka važna svojstva ove strukture.
Međutim, tek nedavno, 2004. godine, fizičari Andre Geim i Konstantin Novoselov na Sveučilištu u Manchesteru grafen su izolirali i mogu biti duboko poznati.
Proučavali su grafit i tehnikom mehaničkog pilinga uspjeli su izolirati sloj materijala ljepljivom trakom. Ovim postignućem par je 2010. dobio Nobelovu nagradu.
Važnost grafena za Brazil
Brazil ima jednu od najvećih rezervi prirodnog grafita, materijala koji sadrži grafen. Prirodne rezerve grafita dosežu 45% ukupnog svijeta.
Iako se pojava grafita primjećuje na čitavom brazilskom teritoriju, iskorištene rezerve nalaze se u Minas Geraisu, Ceará i Bahia.
Uz obilne sirovine, Brazil također ulaže u istraživanja na tom području. Prvi laboratorij u Latinskoj Americi posvećen istraživanju grafena nalazi se u Brazilu, na Universidade Presbiteriana Mackenzie u Sao Paulu, pod nazivom MackGraphe.
Proizvodnja grafena
Grafen se može pripremiti iz karbida, ugljikovodika, ugljične nanocijevi i grafita. Potonji se najčešće koristi kao polazni materijal.
Glavne metode proizvodnje grafena su:
- Mehanički mikro piling: Grafitni kristal uklanja slojeve grafena pomoću trake koji se talože na podlogama koje sadrže silicijev oksid.
- Kemijski mikro piling: ugljične veze oslabljene su dodatkom reagenasa, djelomično prekidajući mrežu.
- taloženje kemijske pare: stvaranje slojeva grafena nanesenih na čvrstim nosačima, poput metalne površine nikla.
Cijena grafena
Teškoća sinteze grafena u industrijskim razmjerima znači da je vrijednost ovog materijala još uvijek vrlo velika.
U usporedbi s grafitom, cijena mu je tisuće puta veća. Dok se 1 kg grafita prodaje za 1 dolar, prodaja 150 g grafena vrši se za 15 000 dolara.
Zanimljivosti o grafenu
- Projekt Europske unije, nazvan Graphene Flagship, izdvojila oko 1,3 milijarde eura za istraživanje vezano uz grafen, primjene i razvoj proizvodnje u industrijskim razmjerima. U ovom projektu sudjeluje oko 150 institucija u 23 zemlje.
- Prvi kofer razvijen za svemirska putovanja u svom je sastavu grafen. Njegovo lansiranje zakazano je za 2033. godinu, kada NASA planira izvesti ekspedicije na Mars.
- Borofen je novi konkurent grafenu. Ovaj je materijal otkriven 2015. godine i smatra se poboljšanom verzijom grafena, jer je još fleksibilniji, otporniji i provodljiv.
Grafen u Enem-u
U testu Enem 2018, jedno od pitanja Prirodne znanosti i njihove tehnologije bio o grafenu. Provjerite dolje komentirano rješenje ovog problema.
Grafen je alotropni oblik ugljika koji se sastoji od ravnog sloja (dvodimenzionalni niz) zbijenih atoma ugljika debljine samo jednog atoma. Njegova je struktura šesterokutna, kao što je prikazano na slici.
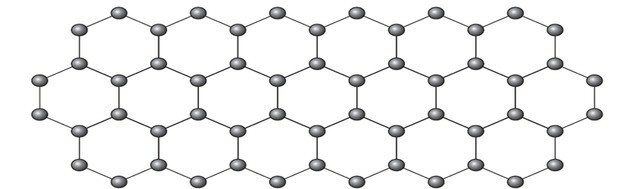
U ovom rasporedu atomi ugljika imaju hibridizaciju
a) sp linearne geometrije.
b) sp2 ravninske trigonalne geometrije.
c) sp3 naizmjenično sa sp-hibridiziranim ugljicima linearne geometrije.
d) sp3d planarne geometrije.
e) sp3d2 sa šesterokutnom ravnom geometrijom.
ispravna alternativa: b) sp2 ravninske trigonalne geometrije.
Ugljična alotropija nastaje zbog njegove sposobnosti stvaranja različitih jednostavnih tvari.
Budući da ima 4 elektrona u valentnoj ljusci, ugljik je četverovalentan, odnosno teži stvaranju 4 kovalentne veze. Te obveznice mogu biti jednostruke, dvostruke ili trostruke.
Ovisno o vezama koje stvara ugljik, prostorna struktura molekule mijenja se u raspored koji najbolje prilagođava atome.
Do hibridizacije dolazi kada postoji kombinacija orbitala, a za ugljik to može biti: sp, sp2 i sp3, ovisno o vrsti poziva.
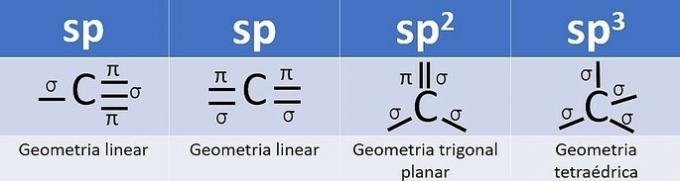
Broj hibridnih orbitala zbroj je sigma (σ) veza koje ugljik stvara, jer veza ne hibridizira.
- sp: 2 sigma veze
- sp2: 3 sigma veze
- sp3: 4 sigma veze
Prikaz grafenskog alotropa u kuglicama i štapićima, kao što je prikazano na slici u pitanju, ne pokazuje prave veze tvari.
Ali ako pogledamo dio slike, vidjet ćemo da postoji jedan ugljik koji predstavlja kuglu i povezuje se s tri druga ugljika čineći strukturu poput trokuta.
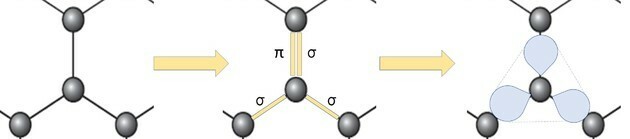
Ako ugljiku trebaju 4 veze i vezan je za 3 ostala ugljika, tada je jedna od tih veza dvostruka.
Budući da ima jednu dvostruku i dvije jednostruke veze, grafen ima sp hibridizaciju2 i, shodno tome, trigonalna planarna geometrija.
Ostali poznati alotropni oblici ugljika su: grafit, dijamant, fuleren i nanocijev. Iako su svi napravljeni od ugljika, alotropi imaju različita svojstva koja proizlaze iz njihove različite strukture.
Pročitajte i vi: Kemija u enemu i Pitanja iz kemije u Enem-u.


