O benzen je organski spoj klasificiran kao aromatski ugljikovodik. Široko se koristi kao sirovina u industriji, u laboratorijskim procesima, u čeličnim tvrtkama i u petrokemijskoj industriji za rafinaciju nafte.
Pročitajte i vi: Metan - najmanji i najjednostavniji ugljikovodik
Formula
Benzen je spoj molekularne formule Ç6H6a tko ima a izuzetno stabilna struktural. Strukturna formula za benzen predstavljena je kako slijedi:
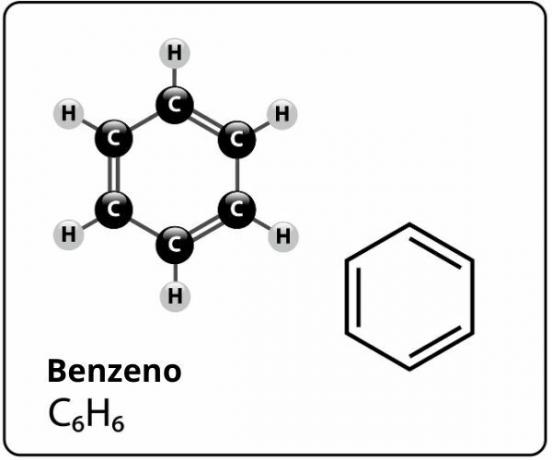
Tko je predložio ovu strukturu za benzen sa šest atoma ugljika povezanih zajedno s izmjeničnim dvostrukim vezama, tvoreći šesterokut i na svaki od njih pričvrstivši atom atoma vodik, bio je to njemački kemičar Friedrich August Kekule, 1866. godine.
Benzen prolazi kroz fenomen tzv rezonancija, u kojem se elektroni u vezama između ugljika razlikuju u svom položaju. Iz tog razloga benzen se može predstaviti na sljedeći način:
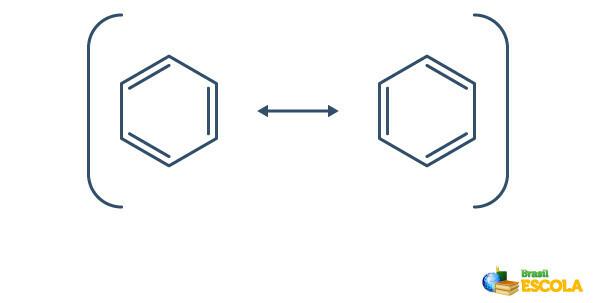
Stvarna struktura benzena posrednik je između gore prikazanih rezonancijskih struktura. To ne znači da se benzen ponekad pojavljuje u jednom obliku, ponekad u drugom, niti da oba oblika postoje istovremeno. Benzen predstavljamo na sljedeći način:
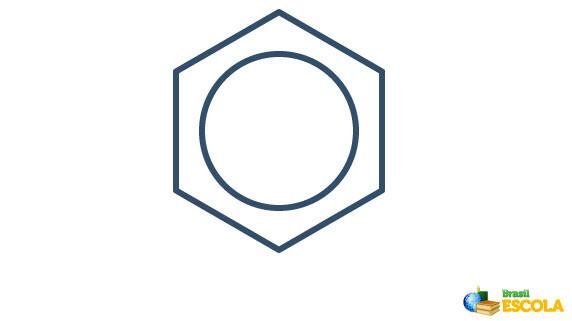
Krug unutar šesterokuta predstavlja rezonanciju između elektrona u vezama.
Značajke
- Benzen je tekućina bezbojna, zapaljiv to je uobičajeno ugodna aroma karakteristična.
- Molekularna formula: C6H6.
- Molarna masa: 78,11 g / mol.
- Gustoća: 0,876 g / cm3.
- Temperatura topljenja: 5,5 ° C.
- Temperatura vrenja: 80,1 ºC - niska temperatura ključanja objašnjava veliku hlapljivost (lakoću isparavanja).
Benzen je otrovna tvar a njegove pare mogu uzrokovati vrtoglavicu, glavobolju i nesvjesticu.
Pročitajte i vi:Ugljični monoksid - izuzetno otrovni plin, bez boje i mirisa
Primjena i toksičnost benzena
benzen je uglavnom se koristi kao sirovina u industriji za proizvodnju drugih tvari, kao što su plastika i polimeri na bazi stirena, smola, ljepila, najlona, guma, maziva, pesticida itd.
Benzen je, uglavnom u laboratorijima, zamijenjen toluenom koji ima polaritet i topljivost slično benzenu, ali je manje toksičan i s višom temperaturom ključanja.
Benzen je unutar skupine kemijske tvari koje se smatraju kancerogenima, uzrokujući oštećenje koštane srži i leukemiju, kada su dugotrajno izloženi u visokim koncentracijama. Kratkoročno, benzen može izazvati vrtoglavicu, pospanost, ubrzani rad srca, napadaje i nesvjesticu.
Budući da je hlapljiva tekućina, benzen lako oslobađa plinove i stoga se onečišćenje benzenom događa uglavnom kroz dišni put.
Gdje se nalazi benzen?
Većina benzena ispušta se u okoliš rezultat ljudskog djelovanja, uglavnom u industrijskim djelatnostima, ali se također može osloboditi kao nusprodukt požara i vulkanskih aktivnosti.
benzen je jedna od sastojaka tvari Nafta i prisutan je u benzinu, a ispušta se u atmosferu izgaranjem automobilskih goriva. Nadalje, nalazi se i u bezalkoholnim pićima i cigaretama.

Polaritet
Benzen je nepolarna molekula, baš kao i svi ostali Ugljikovodici i zato predstavlja vrlo niska topljivost u vodi (0,8 g / L na 15 ° C). U nekim laboratorijskim postupcima benzen se koristi kao organsko otapalo za nepolarne tvari.
Nomenklatura
Postoji pravilo primijenjeno samo na nomenklaturu aromatskih spojeva, odnosno onih koji u svojoj strukturi imaju benzen. Ovo je pravilo podijeljeno u dva slučaja, koja ovise o količini radikala vezanih uz benzenski prsten.
1. SLUČAJ: kada je za benzenski prsten vezan samo jedan radikal, ime se daje slijedeći sljedeće pravilo:
RADIKALNO IME + BENZEN
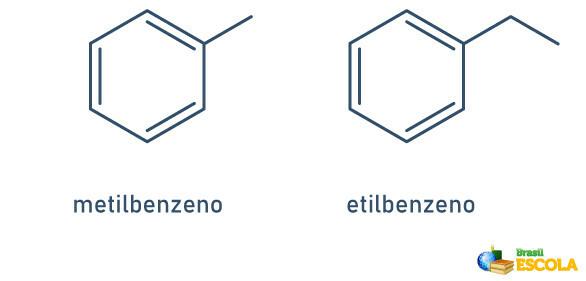
Imajte na umu da nije potrebno naznačiti položaj stabljike.
2. SLUČAJ: kada je za benzen vezano više radikala, naziv slijedi sljedeće pravilo:
RADIKALNI POLOŽAJ + RADIKALNO IME + BENZEN
Pogledajte primjer:

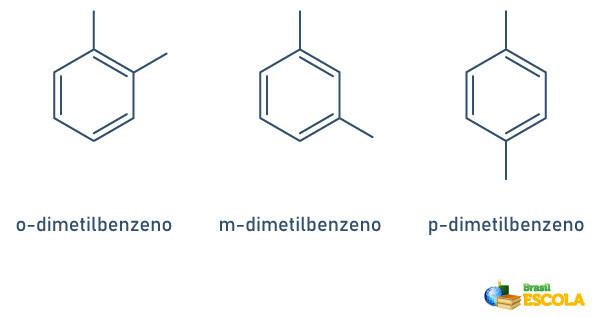
Kada benzenski prsten ima samo dva vezana radikala, postoji posebna nomenklatura koja se može koristiti:
- 1,2 ili orto (o);
- 1,3 ili gol (m);
- 1.4 ili do (p).
Pogledajte primjere:
Pročitajte i vi: Amonijev nitrat - visoko reaktivni spoj koji se koristi u proizvodnji eksploziva
Zanimljivosti
- Benzen je izuzetno kancerogena tvar, a klasificirana je od strane Međunarodne agencije istraživanja raka, u skupini 1, zajedno s duhanom, dizelskim dimom i mesom obrađena.
- Postoji nekoliko regulatornih tijela koja ograničavaju izloženost i emisiju benzena u različitim zemljama. U Brazilu je za ovu ulogu odgovorna Anvisa.
- Prije nego što smo saznali njegove rizike, benzen se zbog ugodnog mirisa koristio u kozmetici, kao što je sredstvo za brijanje.
Napisao Victor Ricardo Ferreira
Učitelj kemije
