dogodi se preobrazbaizohorni kada se zadana masa plina podvrgne promjenama u temperatura koji se okidački tlak mijenja ili obrnuto, s obzirom na to da temperatura i pritisak, u ovom su slučaju izravno proporcionalne količine, dok volumen sustava ostaje nepromijenjen.
Pogledajte i: Što je parcijalni tlak plinova?
Što je izohorna transformacija?
Izohorna transformacija je kada se promjeni temperature i tlaka dogodi kod određene mase plina, ali njegov volumen ostaje isti. Promjena tlaka bit će izravno proporcionalna temperaturi, to jest, ako plin u određenom zatvorenom sustavu udvostruči apsolutnu temperaturu, to će uzrokovati porast tlaka dvostruko više nego što je bio u početku.
Ova vrsta transformacije se također naziva izovolumetrijska ili izometrijska. Izohorski pojam potječe od grčkog Isokhora, na što izo znači "jednak" i khora znači "mjesto ili volumen" (u ovom kontekstu).
Primjeri:
Gume automobila podvrgavaju se izohornoj transformaciji, to možemo primijetiti kad napravimo njegovu kalibriranje.
U vrućim danima tlak na monitoru za umjeravanje veći je nego u hladnim danima. To je zato što se s porastom temperature povećava tlak, budući da volumen ostaje.
Ostali primjeri su dezodoransi u spreju, kod ove vrste proizvoda na naljepnici postoji upozorenje da se ne čuvaju ili izlažu visokim temperaturama, jer, osim što su neke njegove tvari zapaljive, postoji i uvjet izohorne transformacije odn izovolumetrijski. Kako su aerosolni dezodoransi unutar zatvorene boce i u plinovitom stanju, porast temperature dovest će do povećanja tlaka i rizika od eksplozije.
Karakteristike izohorne transformacije
- Stalni volumen.
- Tlak i temperatura izravno su proporcionalni.
Te se karakteristike mogu opisati sljedećim formulama:

Grafik izohorne funkcije
Obratite pažnju na sljedeću tablicu koja opisuje ponašanje plina u odnosu na tlak, temperaturu i rezultirajuću konstantu.
Temperatura (° C) |
Tlak (atm) |
P / T = konstanta |
50 |
5 |
10 |
100 |
10 |
10 |
150 |
15 |
10 |
200 |
20 |
10 |
Imajte na umu da tlak slijedi porast temperature tako da omjer P / T ostaje konstantan, što znači da su tlak i temperatura izravno proporcionalne veličine. Stoga je graf koji opisuje izohorne transformacije linearnog tipa. Izgled:

Tko je otkrio izohornu transformaciju?
Jacques Alexandre César Charles (1746.-1823.) Bio je francuski znanstvenik koji je, proučavajući ponašanje plinova u zatvorenom sustavu za stvaranje preciznog termometra, zaključio studije o izohornim transformacijama.
Znanstvenik Joseph Louis Gay-Lussac (1778.-1850.) Također je razvio studiju o ekspanziji i skupljanju plinovitog sustava. To su bile neovisne analize, ali budući da su došli do istog zaključka, podijelili su bodove. Danas se neki autori pozivaju na posljednja dva fizikalna zakona plinova koji objašnjavaju izobarne transformacije i izohoran poput 1. i 2. zakon Charles-Gay-Lussaca.
Pogledajte i: Gay-Lussac-ov volumetrijski zakon
Vježberiješen
Pitanje 1 - (PUC-RJ) Biciklistička guma baždarena je pod tlakom od 4 atm, hladnog dana, na temperaturi od 7 ° C. Količina i količina ubrizganog plina su jednake. Koliki će biti kalibracijski tlak u gumi kada temperatura dosegne 37 ° C?
a) 21,1 atm
b) 4,4 atm
c) 0,9 atm
d) 760 mmHg
e) 2,2 atm
Razlučivost
Alternativa A
1. korak: identificirajte sustav i izvucite podatke.
Izovolumetrijski sustav
P1 = 4 atm
T1 = 7 ° C
T2 = 37 ° C
P2 =?
Koristeći formulu:
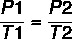
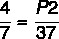
7 x P2 = 37 x 4
P2 = 148/7
P2 = 21,14 atm
Pitanje 2 - (Unifor-CE) Ispitajte donju sliku.
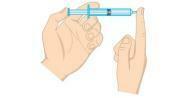
Tlak plina unutar štrcaljke može se smanjiti:
a) stavljanje štrcaljke u ledenu vodu, držeći kraj zatvorenim.
b) stiskanje klipa, držeći kraj zatvorenim.
c) stavljanje štrcaljke u vruću vodu, držeći kraj zatvorenim.
d) otvaranje vrha i izbacivanje polovice zraka iz šprice.
e) povlačenjem klipa, držeći kraj otvorenim.
Razlučivost
Alternativa A. Tlak plina izravno je proporcionalan temperaturi u izohornom sustavu, odnosno bez promjene volumena ili mase plina. Kada dođe do smanjenja temperature, doći će i do pada tlaka.
Napisala Laysa Bernardes Marques de Araujo
Učitelj kemije
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/transformacao-isocorica.htm
