Jedan od najvećih izazova za svakoga tko uči kemiju naziva se elektronička distribucija. Ono što ćemo predstaviti u ovom kontekstu može uvelike olakšati vaše studije povezane s elektronskom konfiguracijom koje je predložio znanstvenik Linus Pauling.
Kroz tablicu je dan maksimalan broj elektrona koji stane u svaki sloj ili razinu energije:
Sloj razine energije Maksimalni broj elektrona
1. K 2
2. L 8
3. M 18
Četvrti N 32
5 ° O 32
6. P 18
7. Q 8
Rastući red energije podrazina je red u nizu dijagonala. Dijagram Linusa Paulinga prikazan je u nastavku:
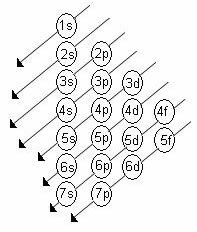
Osnovna pravila:
1. Atomski broj (Z) elementa, u neutralnom stanju, označava broj elektrona koji će se rasporediti. Ovaj je broj predstavljen u donjem lijevom dijelu simbola elementa.
2. Koristeći Paulingov dijagram, počnite distribuirati elektrone od vrha do dna, uzimajući u obzir sve veći redoslijed energije (orijentiran smjerom strelica).
3. Napunite podrazine maksimalnom razinom elektrona. Ako zadani podnivo sadrži samo 6 elektrona, nemojte premašiti tu količinu.
4. Provjerite broj elektrona zbrajanjem u svakom podrazini.
Primijenimo to u praksi?
Rasporedite elektrone atoma željeza (Z = 26).
Ako je atomski broj 26, to znači da u normalnom atomu željeza ima 26 elektrona. Primjenjujući Paulingov dijagram, imat ćemo:
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)

Napisala Líria Alves
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Pravila elektroničke distribucije"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm. Pristupljeno 27. lipnja 2021.