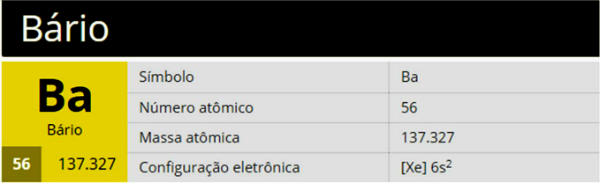
Barij je kemijski element sa simbolom Ba, atomskim brojem 56 i atomskom masom 137,327, koji pripada skupini 2 (Obitelj 2A) periodnog sustava, a predstavlja zemnoalkalni metal.
Ime mu potječe od grčkog barys a znači teška.
Značajke
Na sobnoj temperaturi nalazi se u krutom stanju, meke konzistencije i srebrnaste boje. Međutim, u prirodi ga nema u svom čistom obliku, jer se lako oksidira u dodiru sa zrakom.
Barij se nalazi u rudama barita (BaSO4) i witerite (BaCO3). Glavna rudarska područja za ove rude javljaju se u Velikoj Britaniji, Italiji, Češkoj, SAD-u i Njemačkoj.
Barij ima visoka tališta (1000 K - 727 ° C) i vrelište (2170 K - 1897 ° C). Još uvijek je dobar provodnik električne energije.
Vrlo je reaktivan u dodiru s vodom i alkoholom. Njegova reakcija s vodom stvara hidroksid i oslobađa se vodik.
Topljivi barijevi spojevi su toksični za tijelo. Iako se nalazi u vodi i hrani, količina prisutnog barija nije dovoljna da izazove zdravstvene probleme.
Zbog velike oksidacijske moći barij se mora čuvati u mineralnom ulju.
Saznajte više, pročitajte i:
- Kemijski elementi
- Periodni sustav elemenata
aplikacije
Među glavnim primjenama barija su:
- U svom čistom obliku koristi se za uklanjanje kisika iz elektroničkih ventila;
- Otrov za štakore, u obliku barijevog karbonata;
- Koristi se kao bijeli pigment u bojama;
- Proizvodnja stakla;
- Barijev sulfat koristi se kao fluid za bušenje naftnih i plinskih bušotina;
- Barijev klorat i nitrat koriste se u proizvodnji zelenog plamena u pirotehničkim bakljama;
- Barijev sulfid pojačava kontrast za rendgenske preglede probavnog sustava i daje se oralno pacijentima. Gutanje ne uzrokuje zdravstvene probleme, jer je tvar netopiva, ne nakuplja se i brzo se uklanja iz tijela;
Iako je barijev sulfid bezopasan, barijev karbonat je izuzetno toksičan i može biti fatalan. Osoba s opijenošću ima poteškoće s disanjem, povraćanjem, drhtavicom, tahikardijom, povišenim krvnim tlakom i salivacijom.
Možda će vas također zanimati:
- Metalne karike
- Bakar
- Litij


