Ako voltmetar upotrijebimo u bateriji, moći ćemo prepoznati razliku u potencijalu (U ili ddp) ili elektromotornoj sili (emf ili E) između dviju elektroda. Međutim, na ovaj način nije moguće identificirati redukcijske ili oksidacijske potencijale svake elektrode.
Znanstvenici su trebali znati ove vrijednosti da bi proučavali procese redukcije oksidacije, pa su ustanovili referentno stanje. To znači da je dogovoreno mjerenje potencijala svake elektrode u odnosu na drugu elektrodu pod sljedećim standardnim uvjetima:
• Temperatura mora biti 25 ° C;
• Tlak pri 1,0 atm;
• Koncentracija otopine u koju je metal uronjen mora biti 1,0 mol / L.
Dakle, izabrana elektroda je vodikova elektroda, koji je predstavljen u nastavku:
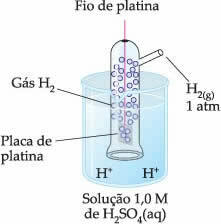
Ova se elektroda sastoji od platinaste žice spojene na platinastu ploču koja ne sudjeluje u reakciji, unutar cijevi koja sadrži plinoviti vodik i uronjena je u kiselu otopinu. U primjeru, otopina je sumporna kiselina.
| Prema dogovoru, standardnoj vodikovoj elektrodi dodijeljena je vrijednost nula, toliko o E0Crvena što se tiče E0oksi. |
Dakle, da bismo pronašli potencijalnu vrijednost bilo koje druge elektrode, samo sagradimo hrpu elektrode koju želimo pomoću standardne vodikove elektrode i izmjerimo ddp voltmetrom. Vrijednost prikazana na voltmetru bit će potencijal tražene elektrode, jer je vrijednost vodika jednaka nuli.
Na primjer, cinkovu elektrodu međusobno povezujemo s vodikovom elektrodom kako bismo saznali koliki je njezin potencijal smanjenja:
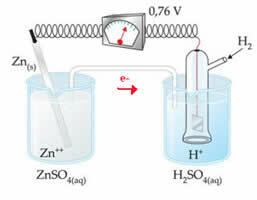
Prema gornjoj shemi, voltmetar je identificirao potencijalnu razliku jednaku +0,76 (? E0 = +0,76). Također primjećujemo da je cinkova elektroda oksidirala, pa je to anoda; a vodikova elektroda se smanjila, što je katoda.
Tako imamo:
? E0 = E0crvena (katoda) - E0 crvena (anoda)
0,76 = 0,00 - E0 crvena (Zn)
E0 crvena (Zn) = 0,00-0,76
E0 crvena (Zn) = -0,76
Negativna vrijednost znači da elektronska struja teče od cinkove elektrode (anode) do vodikove elektrode, ponašajući se tako kao katoda. Da je pozitivan, bilo bi obrnuto, a vodikova elektroda ponašala bi se poput anode. To se može vidjeti kada medusobno povežemo bakrenu elektrodu sa standardnom vodikovom elektrodom:
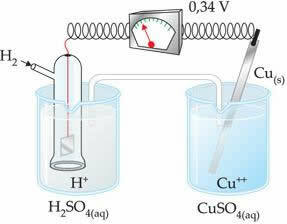
? E0 = E0crvena (katoda) - E0 crvena (anoda)
-0,34 = 0,00 - E0 crvena (Zn)
E0 crvena (Zn) = 0,00 + 0,34
E0 crvena (Zn) = +0,34
Dakle, moguće je definirati redukcijske i oksidacijske potencijale za najrazličitije kemijske vrste. Međutim, Međunarodna unija čiste i primijenjene kemije (IUPAC) preporučuje upotrebu samo redukcijskih potencijala. I, bez obzira na metal koji se koristi, u prikazu baterije, vodikova elektroda je uvijek na prvom mjestu, na primjer:
Pt - H2 (g) 1atm / H3O1 + (aq) 1 mol / L // Cu2 + (aq) 1 mol / L / Cu
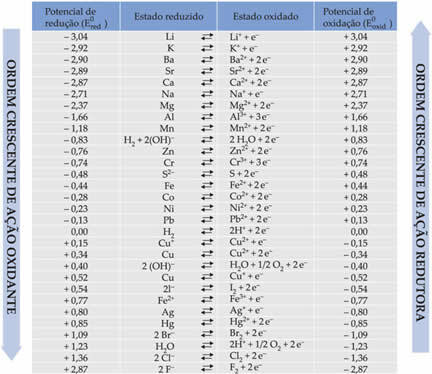
Dolje u tablici navedeni su potencijali postignuti ovom metodom korištenja standardne vodikove elektrode, zajedno s njihovim odgovarajućim polureakcijama:
Napisala Jennifer Fogaça
Diplomirao kemiju
Brazilski školski tim
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/medicao-dos-potenciais-eletroquimicos.htm
