Budući da organskih spojeva ima na tisuće, fenomen izomerije može imati nekoliko oblika. Stoga se izomerija u osnovi može klasificirati u dvije vrste: ravna ili ustavna izomerija i svemirska izomerija ili stereoizomerija. Svaka spomenuta vrsta može se podijeliti, kao što je prikazano na sljedećem dijagramu:
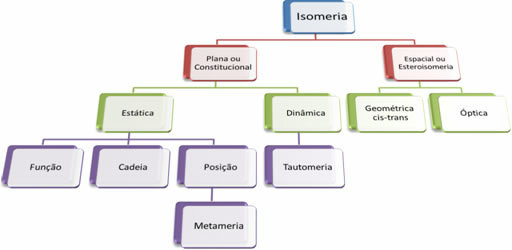
Pogledajte svaki slučaj:
1. Ravna ili ustavna izomerija: Izomeri ovog tipa imaju istu molekulsku formulu i razlikuju se po ravnim strukturnim formulama. Pet je slučajeva ravninske izomerije: funkcija, lanac, položaj, metamerizam i tautomerija.
1.1.Funkcionalna ili funkcionalna izomerija: Razlika između izomera je u funkcionalnoj skupini.
Primjer: Molekularna formula C3H6O
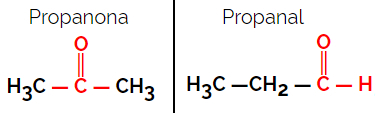
Imajte na umu da je propanon iz skupine ketona, a propanal iz skupine aldehida.
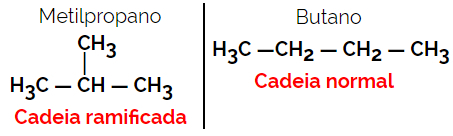
1.2. Lančani ili skeletni izomeri: Razlika između izomera je u vrsti lanca. Na primjer, jedan je izomer otvoreni, a drugi zatvoreni, ili je jedan normalni, a drugi razgranati lanac, ili je jedan homogeni lanac, a drugi heterogeni lanac.
Primjer: Molekularna formula C4H10
1.3.Pozicijska ili pozicijska izomerija: Razlika je u položaju nezasićenja, funkcionalne skupine, heteroatoma ili supstituenta.
Primjer: Molekularna formula C4H6

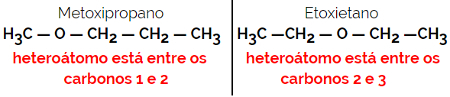
1.4.Kompenzacijska izomerija ili metamerija: To je posebna vrsta izomerije položaja, gdje je razlika u položaju heteroatoma.
Primjer: Molekularna formula C4H10O
1.5.Dinamična izomerija ili tautomerija: To je posebna vrsta izomerije funkcije, u kojoj izomeri koegzistiraju u dinamičkoj ravnoteži u otopini. Dvije su glavne vrste tautomerije između ketona i enola (ketoenolska ravnoteža) i između aldehida i enola (aldoenolska ravnoteža).
Primjer: Molekularna formula C3H6O
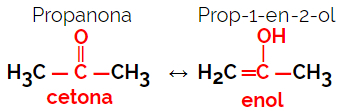
2. Svemirska izomerija ili steroizomerija: U ovom slučaju, razlika između izomera može se vizualizirati samo kroz orijentaciju njihovih atoma u prostoru. Postoje dvije vrste stereoizomerije: geometrijska izomerija i optička izomerija.
2.1.Geometrijski ili cis-trans izomeri: Razlika je u tome što je izomer nazvan kao cis ima iste ugljikove ligande u dvostrukoj vezi ili u cikličkim spojevima na istoj strani ravnine. Izomerni ligandi trans nalaze se na suprotnim stranama.
Primjer: Molekularna formula C2H2Kl2

Ti se spojevi zovu stereoizomeri.
2.2.Optički izomer: Pojavljuje se kada su izomeri sposobni odbiti snop polarizirane svjetlosti. Ako savija polarizirani svjetlosni snop ulijevo, to je levorotarijski izomer, ali ako se savija udesno, naziva se desnoruki izomer.
Primjer:
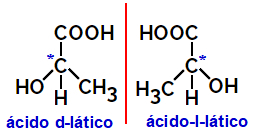
Asimetrične molekule poput gore prikazanih, koje su međusobne zrcalne slike i koje se ne mogu nadgraditi, nazivaju se enantiomeri.
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm
