Otopina je homogena smjesa dviju ili više tvari.. Kao, na primjer, otopina soli (otopljene tvari) otopljene u vodi (otapalo).

Ovaj postupak je vrlo važan, posebno u kemijskim laboratorijima i industriji, jer kemičar treba pripremiti otopine s poznatim koncentracijama. Nadalje, u eksperimentalnim aktivnostima koriste se otopine s vrlo niskim koncentracijama, pa se uzorak koncentrirane otopine razrijedi do željene koncentracije.
Svakodnevno, nekoliko puta, a da toga nismo ni svjesni, provodimo postupak razrjeđivanja otopina. Na primjer, pakiranje proizvoda za čišćenje i kućnu higijenu, poput dezinficijensa, savjetuje da se razrijede prije upotrebe. Neki proizvođači na naljepnicama proizvoda predlažu da se razrijedi vodom u omjeru 1 do 3, odnosno za svaki dio proizvoda moraju se dodati 3 dijela vode. To je učinjeno jer je proizvod vrlo koncentriran i čvrst te može oštetiti mjesto na kojem će se nanositi ako se ne razrijedi na pravi način. S druge strane, ako ga razrijedite više nego što bi trebalo, možete izgubiti novac, jer proizvod neće postići željeni rezultat.

Drugi je primjer kada radimo sokove. Oznake mnogih koncentrata sokova pokazuju da čašu soka treba razrijediti ili pomiješati s 5 čaša vode. Dakle, sok je "slabiji", odnosno manje koncentriran.
Zamislite da ste takav sok razrijedili u 3 L vode. Ako je početna koncentracija soka bila 40g / L, to znači da je imao masu od 40g za svaku litru otapala. Ali budući da ćemo imati 3 L, masa će se podijeliti s 3, a koncentracija će tada iznositi približno 13, 33 g / L ili 13 grama za svaku litru otopine. Međutim, u cijeloj otopini i dalje ostaje masa 40 g otopljene tvari.
Izračun ove nove koncentracije može se izvršiti na sljedeći način:
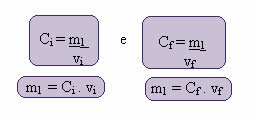
Gdje indeksi i i f predstavljaju, odnosno, početnu i konačnu vrijednost. Budući da se vrijednost m1 nije promijenila, možemo izjednačiti jednadžbe:
Çi. vi = Cf. vf
Zamjena vrijednosti koje imamo, prema prethodnom primjeru, imajte na umu:
Početno rješenje:
Çi: 40g / L
m1: 40g
vi: 1L
Konačno rješenje:
Çf: ?
m1: 40g
vf: 3L
Çi. vi = Cf. vf
(40 g / L). (1 L) = Cf. 3L
Çf = 40 g / L
3
Çf = 13,333 g / L
Isto obrazloženje vrijedi i za molarnu koncentraciju (M) i za maseni postotak otopljene tvari ili titra (T):
Mi. vi = Mf. vf i Ti. vi = Tf. vf
Napisala Jennifer Fogaça
Diplomirao kemiju
Brazilski školski tim
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm
