Baza je anorganska tvar koji prema švedskom kemičaru Svante Arrhenius, kad se stavi u vodu, pati od pojave ionska disocijacija, u kojem je izdanje ioni: kation (Y+) i hidroksid anion (OH-).

Opća formula Arreniusove baze
Y skupina a baza to može biti bilo koji metal ili amonijeva skupina (NH4+), koji se tijekom disocijacije oslobađaju u vodi kao kationi, što se može vidjeti u jednadžbi koja predstavlja postupak:
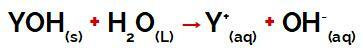
Jednadžba koja predstavlja disocijaciju baze
Pogledajte dolje neke vrlo važne informacije u vezi s klasifikacijom i nomenklaturom baze.
1) Klasifikacija glede topljivost baza(sposobnost za rastopiti u vodi)
Baze topljiv: imaju alkalijski metal ili amonij u sastavu;
Baze teško topljiv: imati zemnoalkalijski metal u sastavu. Primjer: magnezijev hidroksid, široko korišten kao antacid i laksativ;
baze praktično netopiv: ima bilo koji drugi metal u sastavu. Primjer: aluminijev hidroksid, široko korišten kao antacid.
2) Klasifikacija s obzirom na osnovna snaga(sposobnost za razdvojiti u vodi)
Baze jaka: sadrže alkalijske ili zemnoalkalijske metale, osim magnezija, u sastavu;
Baze slab: ima bilo koji drugi metal u sastavu.
3) Osnovna nomenklatura
Da biste imenovali bazu, samo slijedite pravilo imenovanja u nastavku:
Hidroksid + de + naziv metala ili amonijaka
Primjer: Ca (OH)2 → kalcijev hidroksid
Ako baza ima kemijski element koji ne pripada obiteljima IA, IIA ili IIIA (a to nije srebro ili cink), ispred imena elementa, rimskim brojevima, moramo naznačiti broj hidroksili:
Primjer: Ti (OH)4 → titan hidroksid IV
Ja, Diogo Lopes
Izvor: Brazil škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm