THE teorija okteta predložio je Newton Lewis, koji je u studijama primijetio da se atomska interakcija događa tako da svaki element stekne elektroničku stabilnost plemenitog plina, odnosno osam elektrona u valentni sloj. Međutim, u nekim se molekulama događa ono što se naziva širenjem ili skupljanjem okteta, odnosno središnji atom uspostavlja manje ili više predviđene veze.
Pročitajte i vi: Kovalentna veza - klasifikacije i karakteristike
Kako djeluje teorija okteta?
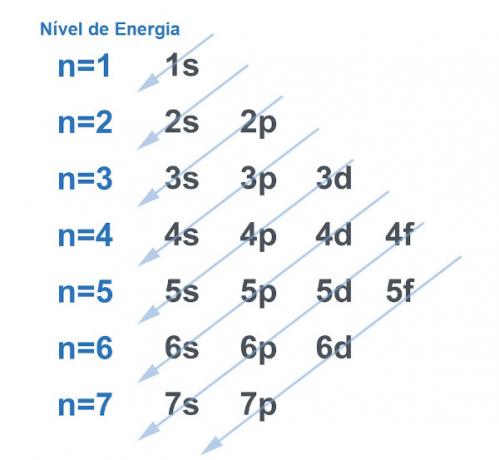
Naravno, svi sustavi teže tražiti put do steći što veću stabilnost, i to nije drugačije s atomom. Atomi su "bazne čestice" bilo koje materije i svaka u svojoj strukturi ima elektrosferu. Ova je elektrosfera bila podijeljena sa Linus Pauling u energetskim razinama i podrazinama. Pauling je razvio dijagram kako bi pokazao kako bi izgledala raspodjela elektrona oko jezgre atoma.
Pogledajte sliku ispod:

Svaka razina i podnivo sadrže iznos od elektroni. Praveći analogiju, možemo reći da je svaka razina polica, a svaka podrazina kutija. U svaku kutiju stanite dva elektrona. Atom je stabilan kad su svi njegovi elektroni upareni, odnosno kada postoje sve kutije s po dva elektrona.
Primjer:
Izvršimo elektroničku raspodjelu kisika (O) koji u svom prirodnom stanju ima osam elektrona.

Primijetite da u valentnom sloju (L sloj, u podrazini) imamo dva nesparena elektrona. Upravo ti elektroni uspostavljaju kemijske veze s drugim elementima u potrazi za formiranjem elektroničkih parova.
Teorija okteta temelji se na matematici zbrajanja elektrona. Ako svi podrazini posljednje elektronske ljuske imaju po dva elektrona, valentna će ljuska imati ukupno osam elektrona i, prema tome, atom će biti stabilan.
Pročitajte i vi: Kvantni brojevi - brojevi povezani s količinom energije elektrona
plemeniti plinovi
Plemeniti plinovi su jedini elementi koji može se naći u prirodi u monoatomskom obliku, odnosno bez uspostavljanja veze s drugim atomom. To je zato što imaju elektroničku stabilnost. Gotovo svi imaju osam elektrona u valentnoj ljusci., pokoravajući se pravilu okteta, s izuzetkom plina helija koji ima samo dva elektrona.

Iznimke od teorije okteta
Neki se spojevi uspiju stabilizirati s više ili manje od osam elektrona u valentnoj ljusci. U tim se slučajevima događaju iznimke od teorije okteta.
proširenje okteta
To se uglavnom događa s fosforom (P) i sumporom (S), koji su relativno veliki atomi i imaju poddigluk "d". U ovom slučaju, atom u svojoj zadnjoj ljusci drži više od osam elektrona.
Primjer:

U slučaju sumpornog heksafluorida, središnji je element ostao 12 elektrona, prelazeći 8 potrebnih za stabilizaciju prema pravilu okteta. U ovom je slučaju došlo do širenja okteta.
stezanje okteta
Događa se s berilijem (Be), borom (B) i nekim oksidi dušika. Pogledajte primjer:

U slučaju bornog trifluorida, atomi fluora dobivaju potrebnih osam elektrona u valentnoj ljusci dijeljenjem elektronički s borom, poštujući pravilo okteta, ali središnji atom (bor) se ne stabilizira sa šest elektrona, pa nastaje jedan kontrakcija okteta.
Također pristupite: Klasifikacija sigma veze: koji su kriteriji?
Riješene vježbe
Pitanje 1 - (Mackenzie-SP) Da bi atomi sumpora i kalija dobili elektroničku konfiguraciju jednaku konfiguraciji plemenitog plina, potrebno je da:
(Podaci: atomski broj S = 16; K = 19.)
A) sumpor prima 2 elektrona, a kalij 7 elektrona.
B) sumpor daje 6 elektrona, a kalij 7 elektrona.
C) sumpor daje 2 elektrona, a kalij 1 elektron.
D) sumpor prima 6 elektrona, a kalij 1 elektron.
E) sumpor prima 2 elektrona, a kalij 1 elektron.
Razlučivost
Alternativa E. Sumpor je element stupca 16 ili obitelji 6A. Elementi ove obitelji teže primati dva elektrona kako bi tvorili elektroničke parove i imaju ukupno osam elektrona u valentnoj ljusci. Elementi obitelji 1A, a to su alkalni metali, imaju samo jedan elektron u valentnoj ljusci. Darujući ovaj elektron, prethodni sloj postaje valentni sloj, već s osam elektrona, kako nalaže pravilo okteta.
Pitanje 2 - Procijenite sljedeće izjave kao istinite (T) ili lažne (F).
I () Pravilo okteta kaže da je u valentnoj ljusci potrebno osam elektrona da bi atom bio stabilan.
II () Valentni sloj je drugi elektronički sloj atoma.
III () Klor (Cl), iz obitelji halogena, nastoji dobiti dva elektrona da bi stekao stabilnost.
IV () Natrij (Na), element iz porodice 1A, nastoji izgubiti jedini elektron u svojoj valentnoj ljusci.
Označite ispravnu alternativu:
A) I, III i IV su istiniti.
B) I i IV su istiniti.
C) Istina je samo II.
D) Samo je IV lažan.
E) Sve su istinite.
Razlučivost
Alternativa B. I i IV su istina. Izjava II je netočna, jer je valentni sloj posljednji elektronički sloj atoma, a ne drugi. A izjava III kaže da klor teži dobivanju dva elektrona, što ne provjerava budući da klor dolazi Obitelj 7A ili 17 teži dobivanju samo jednog elektrona da bi na taj način stekla elektroničku konfiguraciju plina plemenita.
Napisala Laysa Bernardes Marques de Araújo
Učitelj kemije