Na organske reakcije eliminacije su oni kod kojih se atomi ili skupine atoma molekule uklanjaju ili uklanjaju iz nje, stvarajući novi organski spoj, uz anorganski spoj koji nastaje dijelom koji je bio obrisano.
Jedna vrsta reakcije eliminacije je dehidracija, u kojoj je molekula koja se gubi voda. Dehidracija alkohola (spojevi koji imaju OH skupinu vezanu za zasićeni ugljik u otvorenom lancu) može se odvijati na dva načina: intramolekularne i intermolekularne.
"Intra" znači "unutra", dakle, intramolekularna dehidracija alkohola događa se kada molekula vode izlazi iz "unutar" same molekule alkohola. U tom će slučaju nastali organski proizvod biti alken.
Ova se reakcija odvija samo u prisutnosti katalizatora koji djeluje kao sredstvo za sušenje i većinu vremena je koncentrirana sumporna kiselina (H2SAMO4), a temperatura bi trebala biti oko 170 ° C.
Primjer:
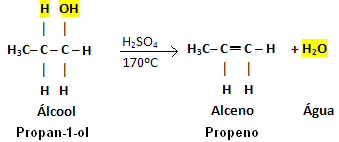
Imajte na umu da je OH grupa napustila, a vodik napustio susjedni ugljik, što je dovelo do vode. Nadalje, stvorena je dvostruka veza koja je dovela do alkena.
Objekt koji trpi dehidraciju slijedi sljedeći silazni redoslijed:
Tercijarni alkoholi> Sekundarni alkoholi> Primarni alkoholi
Ali što kada OH skupina dođe u sredinu ugljikovog lanca? Atom vodika iz kojeg će se osloboditi susjedni atom ugljika i formirati molekulu vode?
Na primjer, sljedeći je 2-metilpentan-3-ol. Imajte na umu da je jedan susjedni atom ugljika tercijarni (označen crvenom bojom), dok je drugi sekundarni (istaknut plavom bojom):
H OH H
│ │ │
H3C─ Ç ─ Ç ─ Ç ─ CH3
│ │ │
H H CH3
Vodik vezan za tercijarni atom ugljika bit će lakše napustiti, jer je njegov elektronegativni karakter jednak δ+1Dakle, što je karakter ugljika manje negativan, to će veza između njih biti slabija i bit će lakše raskinuti njihovu vezu.
U ovakvim slučajevima nastaju svi mogući spojevi, ali prevlast će biti dana redoslijedom: Tercijarni alkoholi> Sekundarni alkoholi> Primarni alkoholi.
Tako imamo:
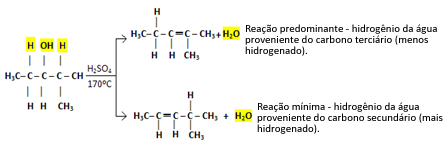
Ova vrsta reakcije pokorava se Saytzefovo pravilo, što to govori bit će veća tendencija da vodik ostavlja ugljik manje hidrogeniranim. Ovo je pravilo upravo suprotno od Pravilo Markovnikova koristi se za reakcije dodavanja.
Da biste nadopunili svoje znanje o ovoj temi, pročitajte i tekst "Intermolekularna dehidracija alkohola”.
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/desidratacao-intramolecular-dos-Alcoois.htm

