Naučite primijeniti prvi zakon termodinamike u različitim situacijama, rješavajte zadaće i provjerite svoje znanje uz riješene i objašnjene zadaće.
Pitanje 1
Prvi zakon termodinamike kaže da:
a) Energija se ne može stvoriti niti uništiti, ali se može pretvoriti iz jednog oblika u drugi.
b) Energija se uvijek čuva, ali se ne može pretvoriti iz jednog oblika u drugi.
c) Energija se može stvoriti ili uništiti, ali se ne može pretvoriti iz jednog oblika u drugi.
d) Energija se ne može sačuvati, ali se može pretvoriti iz jednog oblika u drugi.
Prvi zakon termodinamike je princip očuvanja energije, dakle u sustavu zatvorena, količina energije ostaje konstantna i može se samo transformirati iz jednog oblika u drugi. drugo.
pitanje 2
Pretpostavimo zatvoreni sustav koji primi 100 J topline uz rad od 50 J. Kolika je promjena unutarnje energije sustava?
a) -50 J
b) 0 J
c) 50 J
d) 100J
e) 150J
Provjera znakova:
Primljena toplina je pozitivna Q > 0.
Obavljeni rad je pozitivan W > 0.
Prema prvom zakonu imamo:
pitanje 3
Idealan plinski sustav izmjenjuje 500 džula topline s vanjskim okolišem. Pretpostavljajući da je ovaj proces izometrijsko hlađenje, odredite rad odnosno unutarnju energiju.
a) 500 J i 0 J
b) - 500 i 0 J
c) 0 J i 500 J
d) 0 J i - 500 J
e) -500 J i 500 J
Budući da je proces izometričan, nema promjene volumena, pa je rad jednak nuli.
Prema prvom zakonu termodinamike:
Budući da se radi o hlađenju, sustav gubi toplinu, stoga:
pitanje 4
8 mola idealnog plina u sustavu klip-cilindar komprimira se radom od 1000 J. Tijekom procesa gubi se 400 J topline u vanjsku okolinu. Njegova unutarnja energija i promjena njegove temperature jednake su
Zadano: R = 8,31 J/mol. K
a) - 1400 J i približna varijacija od 6 K
b) 600 J i približna varijacija od 6 K
c) 600 J i približna varijacija od 14 K
d) - 1400 J i približna varijacija od 14 K
unutarnja energija
Kako sustav prima rad, njegov predznak je negativan, kao i toplina koja se pritom gubi.
Prvi zakon termodinamike je:
Zamjenom vrijednosti dobivamo:
R = 8,31 J/mol K
Temperatura
Po Jouleovom zakonu imamo:
pitanje 5
Savršeni plin podvrgava se kompresiji, pri čemu vrši rad od 500 J. Na kraju ove transformacije unutarnja energija sustava promijenila se za 200 J manje nego na početku. Količina topline koju je plin izmijenio bila je
a) - 700 J
b) - 300 J
c) 300J
d) 0J
e) 700J
Budući da je rad primljen, odnosno otporan rad, predznak mu je negativan.
Zamjena vrijednosti u jednadžbu prvog zakona termodinamike:
pitanje 6
(CEDERJ 2021) U fazi ciklusa koju izvodi idealni plin u klimatizacijskom uređaju, tlak plina se povećava zadržavajući njegov volumen konstantnim. U ovoj fazi ciklusa, rad W koji je izvršio plin, količina topline Q koju je on apsorbirao i promjena ΔT njegove temperature su:
a) W < 0, Q < 0 i ΔT < 0
b) W = 0, Q > 0 i ΔT > 0
c) W = 0, Q = 0 i ΔT = 0
d) W > 0, Q > 0 i ΔT > 0
Podaci:
Tlak P raste;
Volumen ostaje konstantan;
Raditi
Kako je obujam konstantan, rad W je jednak nuli.
Prvi zakon termodinamike glasi ovako:
Budući da je toplina pozitivna, promjena unutarnje energije također će biti pozitivna.
Toplina
Budući da se toplina apsorbira, ona je pozitivna.
Temperatura
Prema zakonu o plinu:
Gdje,
n je broj molova
R je univerzalna plinska konstanta
Dakle, temperatura ovisi samo o tlaku, jer je volumen konstantan, jer je pozitivan.
pitanje 7
(UNICENTRO 2018.) Prema prvom zakonu termodinamike, promjena unutarnje energije sustava, ΔU, je dan razlikom između topline izmijenjene s vanjskim okolišem, Q, i rada, W, obavljenog u procesu termodinamički. Uzimajući u obzir ovu informaciju, ako se jednoatomski plin širi tako da uvijek ostane na istoj temperaturi, ta se transformacija može prikazati jednadžbom
a) ΔU + W = 0
b) ΔU − W =0
c) Q − W = 0
d) Q + ΔU = 0
Izotermni proces odvija se bez promjene temperature.
Energija je povezana s temperaturom:
Gdje je n broj molova, a R univerzalna plinska konstanta. Budući da su n i R konstantni, postoji samo varijacija temperature, i
Prvi zakon termodinamike glasi ovako:
pitanje 8
(URCA 2016.) Prema prvom zakonu termodinamike, ako se tijekom izotermnog procesa kroz koji prolazi idealni plin fiksne mase, plin oslobađa količina topline čija je magnituda 50 cal, tada su promjena unutarnje energije i rad koji obavi plin u ovom procesu, odnosno:
a) 0 i 50 kal.
b) 50 cal i 0.
c) 0 i 0.
d) 50 cal i -50 cal.
e) 0 i -50 kal.
Promjena unutarnje energije izravno je povezana s promjenom temperature. Kako je proces izoterman, nema promjene temperature, pa .
Iz prvog zakona termodinamike:
Budući da se toplina oslobađa, predznak joj je negativan.
pitanje 9
(UFRN 2012.) Biomasa je jedan od glavnih izvora obnovljive energije i stoga su strojevi koji je koriste kao gorivo za proizvodnju električne energije važni s ekološkog gledišta. Vrlo čest primjer je korištenje biomase za pogon parne turbine za stvaranje rada. Slika sa strane shematski prikazuje pojednostavljenu termoelektranu.
U ovoj termoelektrani izgaranjem biomase u ložištu proizvodi se toplina koja zagrijava vodu u kotlu i stvara paru pod visokim pritiskom. Para se pak kroz cijevi vodi do turbine koja pod njezinim djelovanjem počinje okretati svoje lopatice.
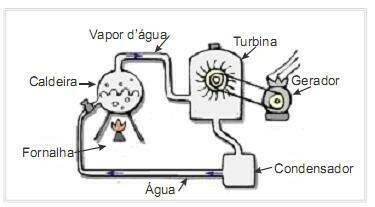
Pretpostaviti zanemarive gubitke topline zbog temperaturnih razlika između dijelova ovog toplinskog stroja i okoline. U tom kontekstu, varijacija unutarnje energije kotlovske vode
a) veći je od zbroja topline koja mu je dovedena izgaranjem biomase i rada turbine.
b) jednak je zbroju topline koja mu je dovedena izgaranjem biomase uz rad turbine.
c) jednak je razlici između topline koja mu je dovedena izgaranjem biomase i rada turbine.
d) veća je od razlike između topline dovedene izgaranjem biomase i rada turbine.
Voda u kotlu dobiva energiju u obliku topline izgaranjem goriva i oslobađa energiju u obliku rada turbine.
pitanje 10
(UECE 2021) Što se tiče svojstava plinova, obratite pozornost na sljedeće izjave:
ja Za idealan plin, unutarnja energija je samo funkcija tlaka.
II. Toplina koju apsorbira plin pri promjeni stanja neovisna je o procesu.
III. Unutarnja energija idealnog plina samo je funkcija temperature i neovisna je o procesu.
IV. U izotermnom širenju idealnog plina, njegov rad jednak je apsorbiranoj toplini.
Točno je ono što je navedeno samo u
a) I. i II.
b) III i IV.
c) I. i IV.
d) II i III.
III. ISPRAVNO. Unutarnja energija idealnog plina samo je funkcija temperature i neovisna je o procesu.
Promjena unutarnje energije izravno je povezana s promjenom temperature.
Gdje je n broj molova, a R konstanta idealnog plina, budući da je konstanta, samo temperatura određuje unutarnju energiju plina.
IV. ISPRAVNO. U izotermnom širenju idealnog plina, njegov rad jednak je apsorbiranoj toplini.
Budući da je izotermna, nema promjene temperature, pa je promjena unutarnje energije jednaka nuli. Po prvom zakonu termodinamike:
Saznajte više uz:
- Prvi zakon termodinamike
- Termodinamika: zakoni, pojmovi, formule i vježbe
- Vježbe iz termodinamike
- zakon o plinu
ASTH, Rafael. Vježbe iz prvog zakona termodinamike.Sve je bitno, [n.d.]. Dostupno u: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Pristup na:
Vidi također
- Vježbe iz termodinamike
- Termodinamika
- adijabatska transformacija
- Vježbe iz termokemije
- Prvi zakon termodinamike
- Prirodne znanosti i njihove tehnologije: Enem
- Termalna energija
- Drugi zakon termodinamike