THE tjesteninaatomski, kao što mu ime govori, to je masa atoma, obično simbolizirana s “mThe” ili “MA”. Međutim, budući da je atom iznimno mali entitet, nevidljiv ljudskim očima, nije moguće izmjeriti njegovu masu, na primjer, pomoću vage. Tako su znanstvenici odredili masu atoma uspoređujući ih s masama drugih atoma.
To se radi i s ostalim jedinicama. Na primjer, jedinica mase je standardni kilogram, što odgovara cilindru visine i promjera 3,917 cm, izrađenom od 10% iridija i 90% platine. Dakle, služi kao usporedba. Na primjer, ako "vagamo" objekt na vagi i utvrdimo da je njegova masa 10 kg, to znači da je njegova masa 10 puta veća od odabranog standarda: 1 kg.
Nemoj sada stati... Ima još toga nakon reklame ;)
Isto vrijedi i za atome. Standard odabran je ugljik-12, a ovom atomu je proizvoljno dodijeljena masa od 12 u. "U" je jedinica atomske mase i stoga je ekvivalentna 1/12 mase atoma ugljika.
Na primjer, kada kažemo da je atomska masa vodika jednaka 1 u, to znači da je kao da ako podijelimo ugljik na 12 dijelova, masa jednog od tih dijelova jednaka je masi atoma vodik. Drugi primjer je sumpor, njegova atomska masa je 32 u, što znači da je njegova masa 32 puta veća od 1/12 mase
12Ç.1 u = 1/12 mase 1 atoma ugljika 12

Jedinica atomske mase je 1/12 mase ugljika-12
Molekularna masa tvari je zbroj atomskih masa elemenata. Na primjer, atomska masa kisika jednaka je 16 u, pa je molekulska masa molekule plina kisika (O2) jednako je 32u.
Kako su laboratorijske tehnike trenutno vrlo napredne, postoje uređaji koji precizno mjere atomsku masu elemenata, kao što je maseni spektrometar. Dakle, to je moguće znati 1 u jednako je 1,66054. 10-24 g.
Mapa uma: atomska masa

*Da biste preuzeli mapu uma u PDF-u, Kliknite ovdje!
Budući da su atomske mase određene s velikom preciznošću, one su dane u periodnom sustavu u obliku decimalnih brojeva. Ali kada idemo raditi izračune, obično koristimo zaokruženi broj, s izuzetkom pokusa koji moraju biti vrlo precizni. Na primjer, ako pogledate periodni sustav, vidjet ćete da je atomska masa kisika jednaka 15 999 u, ali općenito koristimo vrijednost 16 u u izračunima. To se događa i s ugljikom, čija je atomska masa dana s 12,01 u, kao što je prikazano u nastavku:
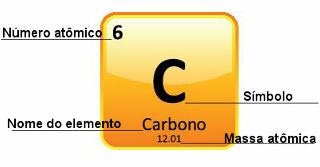
Prikaz ugljika u periodnom sustavu
Elementi koji se pojavljuju u periodnom sustavu zapravo su ponderirani prosjek svih prirodnih izotopa elementa. Dakle, atomska masa koja se pojavljuje u Tablici je također prosjek atomskih masa ovih elemenata. Na primjer, klor (C?) ima dva prirodna izotopa, 35 i 37, čiji su postoci u prirodi 75,76% i 24,24%. Atomske mase svakog od ovih izotopa su različite, pri čemu je C?-35 34,96885 u, a C2-37 36,96590.
Na taj se način izračunava atomska masa elementa uzimajući u obzir masu svakog izotopa i obilje s kojim se pojavljuje u prirodi. U slučaju klora imamo:
Atomska masa elementa klora = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Atomska masa elementa klora = 35,45
Ovo je vrijednost atomske mase klora koja se pojavljuje u periodnom sustavu.
* Mapa uma od mene Diogo Lopes
Autora Jennifer Fogaça
Diplomirao književnost