Mehanizam je simulacija načina na koji se reakcija obrađuje, opisuje korake kroz koje reaktanti prolaze kako bi došli do konačnog proizvoda.
Mehanizmi su predloženi na temelju eksperimenata, jer nije moguće vizualizirati korak po korak reakcije, a vrlo su korisni u Organska kemija, budući da organski spojevi međusobno reagiraju na različite načine: razbijanje veza, stvaranje spojeva posrednici.
Postoje čimbenici koji ometaju konačni produkt reakcije, kao što su, na primjer, priroda otapala, polaritet veza, izmjena elektrona itd. Stoga određeni mehanizam nije uvijek jedini način nastajanja produkta, oni se mogu pojaviti na različite načine, ionski ili preko slobodnih radikala, na primjer.
1. ionski mehanizam: proces koji započinje heterolitičkim prekidom kovalentne veze i stvaranjem iona (karbokation i karbanion).
Pratite mehanizam halogeniranja alkena.
Mehanizam možemo podijeliti u faze:
1. faza: Heterolitički prekid kovalentne veze (Cl — Cl): stvaranje karbokationa i aniona (Cl-).
2. faza: Kloridni anion (Cl-) napad na karbokation.
3. faza: Stvaranje produkta 1,2 - dikloropropana.
Kao što se može vidjeti, halogenacija alkena se događa ionskim mehanizmom.
Napomena: Kao što naziv implicira, halogeniranje se vrši dodavanjem halogena (klora) u molekulu.
2. Mehanizam preko slobodnih radikala: homolitička ruptura kovalentne veze stvara slobodne radikale (vrlo nestabilne i reaktivne), pogledajmo primjer:
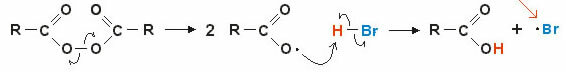
Reakcija počinje razbijanjem peroksidne veze i stvaranjem slobodnih radikala. U srednjem koraku dolazi do napada radikala na polarizirani vodik (H — Br) i posljedično stvaranje novog slobodnog radikala • br (vrlo nestabilna i reaktivna).
Autora Líria Alves
Diplomirao kemiju
Školski tim Brazila
Vidi više!
Radikali u organskoj kemiji
Organska kemija - Kemija - Brazilska škola
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/mecanismos-reacoes-organicas.htm
