Jedan od načina na koji su kemijski elementi organizirani je kroz obitelji, koje odgovaraju vertikalnim redoslijedima periodnog sustava.
Na 18 stupaca tablice grupiraju elemente prema sličnostima u kemijskim svojstvima.
Organiziranje kemijskih elemenata u obitelji bio je praktičan način strukturiranja različitih pronađenih informacija i njihova prezentacija na jednostavan način.
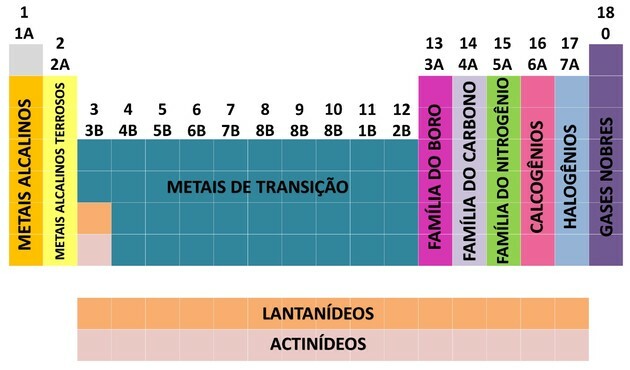
Kako bi se olakšao smještaj kemijskog elementa, obitelji su označene brojevima od 1 do 18 kako slijedi:
Zahvaljujući doprinosu mnogih znanstvenika i raznim pokušajima slaganja podataka, periodni sustav je evoluirao uspostavljajući redoslijed slaganja elemenata.
Nomenklatura obitelji
- Obitelji u tablici podijeljene su na A (reprezentativne) i B (prijelazne), identificirane slovima i brojevima.
- Vas reprezentativni elementi odgovaraju obitelji 0, 1A, 2A, 3A, 4A, 5A, 6A i 7A.
- Vas prijelazni elementi odgovaraju obitelji 1B, 2B, 3B, 4B, 5B, 6B, 7B i 8B.
- Određivanjem Međunarodne unije za čistu i primijenjenu kemiju (IUPAC), obitelji su identificirane u skupine od 1 do 18.
Periodni sustav i elektronička distribucija
Do sličnosti između elemenata iste obitelji dolazi zato što je broj valentnih elektrona atoma u osnovnom stanju jednak za članove određene skupine.
Na primjer:
| 1. skupina | Eletronic distribucija |
|---|---|
| 3čitati | 2-1 |
| 11Na | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
Atomi skupine 1 imaju svoje elektrone raspoređene na više od jedne energetske razine, ali svi imaju valentni elektron.
Uz to, primjećujemo da izrada elektronska distribucija atoma u osnovnom stanju, nalazimo njegov položaj na periodnom sustavu.
reprezentativni elementi
Reprezentativni elementi pokazuju relativno manje složeno kemijsko ponašanje od prijelaznih elemenata i tvore većinu tvari oko nas.
Neke od reprezentativnih obitelji elemenata dobivaju posebna imena, kao što je prikazano u nastavku:
Skupina |
Obitelj | određeno ime | Podrijetlo imena | Elementi | elektronička konfiguracija |
|---|---|---|---|---|---|
| 1 | 1A | alkalni metali | od latinskog lužine, što znači "sive biljke". | Li, Na, K, Rb, Cs i Fr | nas1 |
| 2 | 2A | zemnoalkalijski metali | Izraz "zemaljski" odnosi se na "postojanje na zemlji". | Budi, Mg, Ca, Sr, Ba i Ra | nas2 |
| 13 | 3A | obitelj bora | Ime prvog elementa obitelji. | B, Al, Ga, In, Tl i Nh. | nas2np1 |
| 14 | 4A | obitelj ugljika | Ime prvog elementa obitelji. | C, Si, Ge, Sn, Pb i Fl. | nas2np2 |
| 15 | 5A | Obitelj dušika | Ime prvog elementa obitelji. | N, P, As, Sb, Bi i Mc. | nas2np3 |
| 16 | 6A | Halkogeni | od grčkog khalks, jer su to elementi koji se nalaze u bakarnim rudama. | O, S, Se, Te, Po i Lv. | nas2np4 |
| 17 | 7A | Halogeni | Grčki izraz u značenju tvorci soli. | F, Cl, Br, I, At i Ts. | nas2np5 |
| 18 | 0 | Plemeniti plinovi | Smatralo se da ne reagira s drugim tvarima. | On, Ne, Ar, Kr, Xe, Re i Og. | 1s2 (On) ili mi2np6 |
Kroz tablicu možemo vidjeti da:
- Gore predstavljeni elementi klasificirani su kao reprezentativni jer imaju najenergičniji elektron u s ili p podrazini.
- Elektroni su raspoređeni po razinama energije, a n predstavlja najudaljeniju razinu atoma u osnovnom stanju.
- Reprezentativni elementi, prema preporuci IUPAC-a, pripadaju skupinama ili obiteljima 1,2,13,14,15,16,17 i 18.
O vodik klasificiran je odvojeno od ostalih elemenata. Čak i s 1s elektroničkom konfiguracijom1, on nije dio skupine 1 zbog prezentiranja jedinstvenog ponašanja.
prijelazni elementi
Prijelazni elementi odgovaraju skupinama od 3 do 12. Ovo su ime dobili jer imaju međusobne karakteristike između skupina 1 i 2 i reprezentativnih nemetalnih elemenata.
Vas prijelazni metali su definirani od strane IUPAC-a kao:
Prijelazni element ima nepotpuni d podnivo ili može stvoriti katione s nepotpunim d podrazinom.
Kada je najenergičniji elektron atoma u osnovnom stanju u nepotpunom podrazini, to se karakterizira kao vanjski prijelaz.
Lantanidi i aktinidi su unutarnji prijelazni elementi jer imaju barem jedan nepotpuni podrazina.
Kad elementi imaju elektrone koji ispunjavaju d ili f orbitale, oni pokazuju slična svojstva i mogu se klasificirati u elemente vanjski ili unutarnji prijelaz.
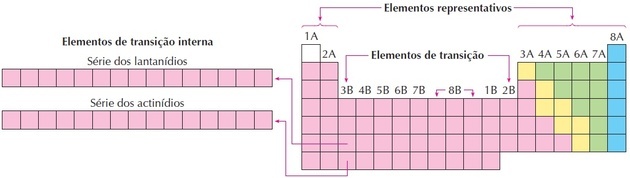
Kao što možemo vidjeti na slici, obitelj 8B odgovara 3 stupca, to su skupine 8, 9 i 10, koje su ovako grupirane jer imaju slične karakteristike.
Glavne karakteristike obitelji
Tablica u nastavku prikazuje glavna svojstva grupa u periodnom sustavu:
| Skupina | Značajke | složene tvari češći |
pojave |
|---|---|---|---|
| 1 | Čvrst i sjajan u ambijentalnim uvjetima. Vrlo reaktivni, mekani i dobri vodiči električne energije. | Soli, hidroksidi i oksidi |
Reagirati s halogenima i oblikovati soli. |
| 2 | Manje reaktivan i tvrđi od skupine 1. Čvrste supstance srebra dobre vodljivosti. | Soli, hidroksidi i oksidi |
Stvaranje soli i oksida. |
| 3 do 12 | Oni tvore komplekse. Oni su metalne krutine, tvrde i lomljive, s izuzetkom žive koja je tekućina. | Soli, oksidi i kompleksi. Primjer: AgNO3, TiO i [Cr (OH)3(H2O)3] |
U mineralima u obliku oksida. |
| 13 | Čvrste tvari u ambijentalnim uvjetima, srebro, osim bora. | Oksidi Primjer: B2O3 |
U mineralima u obliku oksida. |
| 14 | Čvrsta u ambijentalnim uvjetima. | Atomi C i Si mogu se rasporediti u lance i stvarati veliku raznolikost tvari. | U živim organizmima i u obliku silikata ili oksida. |
| 15 | Čvrste tvari, osim dušika koji je plinovit u okolnim uvjetima. | Oksidi i kiseline Primjer: NE2 i H3PRAH4 |
Atmosfera, živi organizmi i minerali. |
| 16 | Čvrste tvari, osim kisika, koji je plinovit u okolnim uvjetima. | Sulfidi i oksidi Primjer: ZnS i SiO2 |
Atmosfera, živi organizmi i minerali. |
| 17 | Oni tvore dvoatomske molekule i vrlo su reaktivni. Loši su vodiči električne energije i topline. Agresivni su prema živim bićima i okolini. | Kiseline i soli. Primjer: HCl i KBr |
Prisutni su u tvarima organske i mineralne. |
| 18 | Vrlo su stabilni i nalaze se u obliku plinova. | Teško tvore složene tvari. | Plinovi u atmosferi. |
Kemijska i fizička svojstva razlikuju jednu obitelj od druge. Kao što smo vidjeli, kemijska svojstva povezana su s elektroni valencije, i preko njih atom stupa u interakciju s drugim, odgovoran za kemijsko ponašanje i kemijske veze formirana.
Fizička svojstva elemenata u istoj skupini mogu se razlikovati ovisno o atomskom broju i masi.
Vježbe
Sad kad znate malo više o obiteljima Periodnog sustava, testirajte svoje znanje i pogledajte što ste naučili.
1) Razmotrite sljedeći izvadak iz Periodnog sustava.
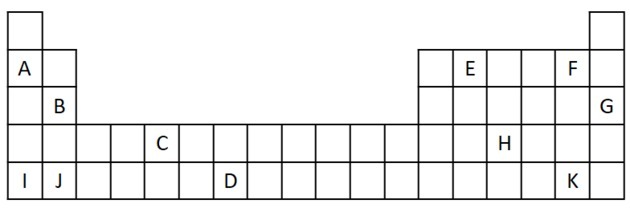
a) Navedi dva elementa koja imaju dva valentna elektrona.
b) Označite element koji burno reagira s vodom stvarajući metalni hidroksid.
c) Označiti nereaktivni element.
d) Navedite dva elementa koja se kombiniraju s alkalnim metalima da bi stvorili soli.
Odgovor:
a) B i J
Dva valentna elektrona odgovaraju skupini 2 koja ima ns elektronsku konfiguraciju2 a u vježbi ih predstavljaju B i J.
b) A, B, I ili J.
A i I predstavljaju elemente obitelji 1; B i J su iz obitelji 2. Kao što smo vidjeli u tablici svojstava, elementi 1. i 2. skupine vrlo su reaktivni i mogu stvarati hidrokside, kao u datim primjerima: KOH i Mg (OH)2.
c) G
Plemeniti plinovi su vrlo stabilni i stoga nisu vrlo reaktivni. Slovo G umetnuto je u tablicu kao element ove obitelji.
d) F i K
Halogeni reagiraju s alkalnim metalima stvarajući soli. Najčešći primjer za to je kuhinjska sol, NaCl.
2) Sljedeća slika prikazuje tri kemijska elementa, s lijeva na desno, litij, natrij i kalij.

Odaberite opciju koja ispravno dovršava svaku od sljedećih izjava.
1.1) "Možemo reći da litij, natrij i kalij ...
(A)... pripadaju istom razdoblju. "
(B)... ima isti atomski broj. "
(C)... pripadaju istoj skupini. "
(D)... ima isti maseni broj. "
1.2) "Elementi litij, natrij i kalij ...
(A)... ima vrlo slična kemijska svojstva. "
(B)... ima vrlo različita kemijska svojstva. "
(C)... su nemetali. "
(D)... reagirati s vodom da bi se stvorile kisele otopine. "
Odgovori:
1.1) (C) pripadaju istoj skupini.
1.2) (A) ima vrlo slična kemijska svojstva.
Te podatke možemo dobiti konzultacijama s periodnim sustavom ili elektroničkom distribucijom elemenata litij, natrij i kalij. Vidjet ćemo da trojica imaju elektron u valentnoj ljusci, a budući da su dio iste skupine, kemijska svojstva su vrlo slična.
3) Razmotrite sljedeću tablicu, u kojoj su prikazani atomski brojevi i elektronička raspodjela nekih kemijskih elemenata.
| Element | kemijski simbol | atomski broj | Eletronic distribucija |
|---|---|---|---|
| Litij | čitati | 3 | 2,1 |
| Berilijum | biti | 4 | 2,2 |
| Fluor | F | 9 | 2,7 |
| neon | Huh | 10 | 2,8 |
| klor | Kl | 17 | 2,8,7 |
| argon | Zrak | 18 | 2,8,8 |
| Kalij | K | 19 | 2,8,8,1 |
| Kalcij | Ovdje | 20 | 2,8,8,2 |
Navedite skupinu svakog elementa.
Odgovor:
Litij i kalij: skupina 1. (Imaju elektron u valentnoj ljusci).
Berilij i kalcij: skupina 2. (U valentnoj ljusci imaju dva elektrona).
Fluor i klor: skupina 17. (U valentnoj ljusci imaju sedam elektrona).
Neon i argon: skupina 18. (U valentnoj ljusci imaju osam elektrona).
Pitanja za prijamni ispit provjerite komentiranom razlučivošću u Vježbe na periodnom sustavu i neobjavljena pitanja na tu temu u Vježbe o organiziranju periodnog sustava.



