Vrenje je promjena iz tekućeg u plinovito stanje. To se događa kada dio tekućine, podvrgnut zadanom tlaku, primi toplinu i dosegne određenu temperaturu.
Količina topline koju tijelo mora primiti da bi se potpuno pretvorilo u paru ovisi o tvari koja ga čini.
Tvar u tekućem stanju nema definirani oblik, poprimajući oblik spremnika koji je sadrži.
Budući da je praktički nerazumljiv, predstavlja kohezivnu silu između čestica koje ga čine.
Da bi prešla u plinovito stanje, tvar mora primati toplinu. Ovo povećanje energije učinit će da molekule vibriraju većim intenzitetom, povećavajući udaljenost između njih.
Na taj način kohezijska sila praktički ne postoji. Tijelo u ovom stanju nema određeni oblik ili volumen.
Gejziri su primjeri vrenja koje se događa s podzemnom vodom koja se nalazi u vulkanskim regijama. Magma zagrijava vodu i kad dosegne određenu temperaturu počinje mijenjati stanje.
Para zauzima veći volumen, povećavajući tlak u podzemnoj šupljini. Kao rezultat, smjesa pare i tekućine izbacuje se na površinu kroz male pukotine.

Karakteristike vrenja
Tekućina vrije po slijedećem uzorku:
- Održavajući konstantni tlak, temperatura tijekom procesa ključanja ostat će konstantna.
- Količina topline po jedinici mase potrebna da bi se tekućina u potpunosti pretvorila u paru naziva se latentna toplina isparavanja. Njegova vrijednost ovisi o tvari koja tvori tekućinu.
- Temperatura na kojoj svaka tvar ključa dobro je određena i naziva se tačkom ključanja.
Savjet: Kad kuhamo hranu, dobro je uključiti vatru kad voda počne ključati. Kako temperatura ostaje konstantna tijekom cijelog procesa ključanja, vrijeme kuhanja bit će isto s jakom ili malom vrućinom. Na taj način štedimo plin i okoliš je zahvalan.
Količina latentne topline
Količina topline koju tekućina mora primiti da bi se pretvorila u paru ovisi o vrijednosti latentne topline isparavanja i njenoj masi.
U nastavku predstavljamo vrijednost latentne topline isparavanja nekih tvari:

Formula
Da bismo izračunali količinu topline potrebne da bi tekućina promijenila stanje, koristimo sljedeću formulu:
Gdje,
Pv: količina topline (vapno)
m: masa (g)
Lv: latentna toplina isparavanja (kal / g)
Primjer:
Koliko je topline potrebno da 100 g etanola zakipi i potpuno se pretvori u paru?
Pv = 100. 204 = 204 000 kal
Temperatura vrenja
Temperatura na kojoj tijelo podvrgava vrenju ovisi o tvari koja ga sačinjava i tlaku kojem je podvrgnuto.
Vrelište tvari određuje se u laboratoriju. Na primjer, vrelište vode, podvrgnuto 1 atmosferi, iznosi 100 ° C. Željezo je 2800 ° C, dok je vodik - 252,8 ° C.
Da biste znali temperaturu promjene faze drugih tvari, također pročitajte vrelište.
Što je tijelo manje pod pritiskom, točka vrenja mu je niža. To znači da u gradovima s velikim nadmorskim visinama kuhanje hrane traje puno duže.
Da bismo brže kuhali hranu, koristimo štednjake pod tlakom. Ova vrsta štednjaka koristi brtveni sustav zbog kojeg je tlak u njemu veći od atmosferskog.
Viši tlak čini i točku ključanja višom. U slučaju vode, ključat će na temperaturi koja može doseći 120 ºC, smanjujući vrijeme kuhanja.
fazne promjene
Općenito se naziva promjena iz tekućeg u plinovito stanje isparavanje, jer obuhvaća, osim vrenja, još dva postupka: isparavanje i grijanje.
Isparavanje se događa postupno, ne treba postići određenu temperaturu. S druge strane, zagrijavanje se događa kada tekućinu stavimo na površinu koja je na temperaturi iznad točke vrenja.
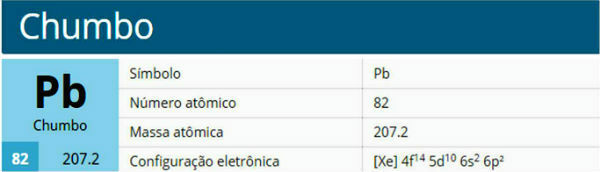
Još uvijek postoje i drugi procesi promjene stanja. Jesu li oni:
- Fuzija
- Očvršćivanje
- Ukapljivanje ili kondenzacija
- Sublimacija
U donjem dijagramu predstavljamo trojicu fizička stanja materije i odgovarajuće promjene stanja:
Da biste saznali više, pročitajte i vi Fizička stanja vode.
Vježbe
Enem - 1999
Tekst treba koristiti za sljedeća dva pitanja.
Posuda pod pritiskom omogućuje kuhanje hrane u vodi mnogo brže od uobičajenih štednjaka. Njegov poklopac ima gumenu brtvu koja ne dopušta ispuštanje pare, osim kroz središnju rupu na kojoj počiva uteg koji kontrolira tlak. Kada se koristi, unutra se nakuplja visoki tlak. Za njegov siguran rad potrebno je promatrati čistoću središnje rupe i postojanje sigurnosnog ventila, koji se normalno nalazi u poklopcu.
Shema lonaca pod pritiskom i dijagram vodene faze predstavljeni su u nastavku.
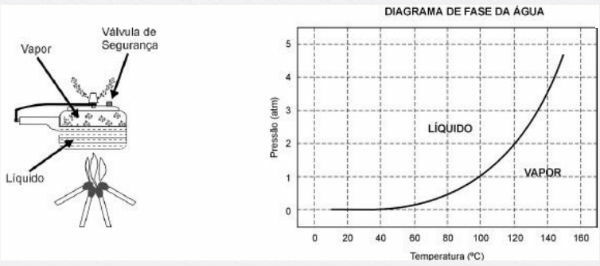
1) Prednost upotrebe lonaca pod pritiskom je brzina kuhanja hrane i to zbog
a) tlak u njemu, koji je jednak tlaku izvana.
b) temperatura njegove unutrašnjosti, koja je iznad temperature ključanja vode u mjestu.
c) količina dodatne topline koja se prenosi na tavu.
d) količinu pare koju ispušta ventil.
e) debljina zida koja je veća od debljine običnih tava.
Alternativa b: na svojoj unutarnjoj temperaturi, koja je iznad temperature ključanja vode u mjestu.
2) Ako zbog ekonomičnosti smanjimo toplinu pod loncem pod pritiskom čim para izađe kroz ventil, kako bismo jednostavno zadržali vrijeme vrenja, vrijeme kuhanja
a) bit će veća jer se tava "ohladi".
b) bit će manji, jer smanjuje gubitak vode.
c) bit će veća s padom tlaka.
d) bit će veći kako se isparavanje smanjuje.
e) neće se mijenjati kako se temperatura ne mijenja.
Alternativa e: neće se mijenjati jer temperatura ne varira.