definira se kao hibridizacija unija nepotpunih atomskih orbitala. Orbitala se klasificira kao nepotpuna kad ima samo jednu elektron unutar njega umjesto dva. Pogledajte prikaz nepotpune i potpune orbitale:

Na slici A imamo potpunu orbitalu; na slici B, nepotpuna orbitala.
Hibridizacija je prirodni fenomen koji se javlja s nekim kemijskim elementima, poput fosfora, sumpora, ugljika itd. Hibridizacija ugljika omogućuje da atomi ovog elementa mogu stvoriti četiri kemijske veze, to jest ugljik stvara samo četiri veze nakon što prođe fenomen hibridizacije.
Ali zašto se ugljik hibridizira i stvara četiri veze? Da bismo razumjeli ovaj fenomen, moramo znati elektroničku distribuciju ovog elementa:
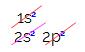
U elektroničkoj raspodjeli ugljika vidimo da je 1s podrazina potpuna (s dva elektrona), 2s je potpun (s dva elektrona), a 2p podrazina je nepotpuna (p podnivo podržava šest elektrona, ali postoji samo dva). Distribuirajući 2p elektrone na reprezentativan način, moramo:
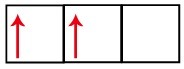
P podnivo ima tri orbitale - u slučaju ugljika, dvije su nepotpune, a jedna prazna. Iz tog bi razloga ovaj element trebao izvoditi samo dvije veze, jer broj nepotpunih orbitala uvijek određuje broj veza.
Međutim, kad primaju energiju iz vanjske okoline, pobuđuju se elektroni prisutni u ugljiku. Dakle, jedan od elektrona prisutnih u podrazinu 2s pomiče se na orbitalu podrazine p koja je bila prazna:
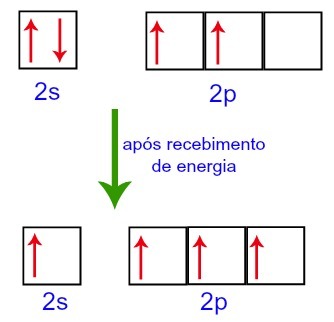
Orbitali ugljika prije i nakon primanja energije iz vanjskog okruženja
Dakle, ugljik ima četiri nepotpune orbitale na svojoj drugoj razini. Zatim se orbitala 2s podrazine spaja s tri p orbitale, što konfigurira fenomen hibridizacija.
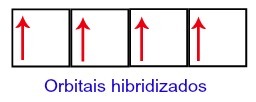
Orbitale ugljika nakon hibridizacije
Ja, Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm
