Elementi nazvani po zemnoalkalijski metali su oni koji pripadaju obitelji 2 ili IIA Periodnog sustava. Takva skupina obuhvaća sljedeće kemijske elemente: Be (berilij), Mg (magnezij), Ca (kalcij), Sr (stroncij), Ba (barij) i radij (Ra).

U valentnoj ljusci imaju dva elektrona, a njihova generička raspodjela predstavljena je s ns2, gdje Ne predstavlja broj posljednjeg nivoa. Zbog ove karakteristike imaju tendenciju da izgube ta dva elektrona, što dovodi do 2+ kationa naboja.
Pojam "zemlja" odnosi se na "postojanje na zemlji", jer se tu nalaze ovi elementi, uglavnom u mineralima. Na primjer, kalcij u obliku spoja kalcijevog fosfata (Ca3(PRAH4)2), nalazi se u zemljinoj kori i služi kao sirovina za proizvodnju fosfora. Prisutan je i u kostima životinja, toliko da kada se one kalciniraju, dobiva se takozvano "koštano brašno", koje sadrži kalcijev fosfat.
Među zemnoalkalijskim metalima najviše se ističu Kalcij to je Magnezij.
- Kalcij
Kalcijev ion (Ca2+) prisutan je u oko 90% naših kostiju i zuba; a kod životinja je prisutan i u njihovim ljuskama. Njegova je funkcija jačati strukturu kostiju i služiti kao mišićni relaksant. Nedostatak kalcija u tijelu može uzrokovati grčeve u mišićima, tetanus i osteoporozu. Zato ga je važno jesti kroz hranu bogatu kalcijem, poput mlijeka i njegovih derivata (maslac, sir itd.), Mesa i povrća.
S druge strane, previše kalcija može uzrokovati opuštanje mišića, bubrežne kamence i bolove u kostima.
Pored spomenute hrane, kalcij je još uvijek prisutan u mnogim dijelovima prirode, posebno u mineralima poput kalcita (CaCO3) ili kalcijev karbonat, koji je sastavni dio vapnenca i mramora, a mramor se koristi u proizvodnji sudopera, kipova, podova i stubišta. Kalcijev karbonat također je graditelj stalaktita i stalagmita u špiljama. Kalcij je prisutan i u prirodnom gipsu (CaSO4. 2 sata2O), naziva se gips. Ova sol može biti dehidrirana, što dovodi do CaSO4 bezvodna, što je školska kreda.
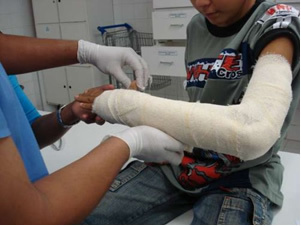
U industriji se proizvodi djevičansko vapno (CaO), gašeno vapno, koje se naziva i hidratirano vapno ili gašeno vapno, što je zapravo kalcijev hidroksid (Ca (OH)2), koji se koristi u bijelim bojama i u pripremi žbuke. Blago zagrijavanje gipsa omogućuje dobivanje hemihidriranog kalcijevog sulfata, koji je gips, a koristi se u građevinarstvu civilno društvo u proizvodnji kalupa u stomatologiji i medicini za zaštitu prijeloma kostiju, poput onog na ruci prikazanom dolje.
- Magnezij
ion od magnezij također ima veliku biološku važnost, jer je prisutan u 70% naših kostiju, što pogoduje djelovanju enzima, mišića i motoričkoj koordinaciji. Njegov nedostatak u tijelu može uzrokovati dezorijentaciju, hipertenziju, drhtanje i slab puls. Stoga bismo trebali jesti sljedeću hranu koja sadrži ovaj element: orašasti plodovi, žitarice i zeleno povrće. Također, višak magnezija u tijelu može uzrokovati pospanost.
Magnezij također postoji u morskoj vodi i mineralima. Koristi se u metalnim legurama, kao što su žrtveni metali (koji oksidiraju umjesto čelika, sprječavajući njegovu koroziju), u kotačima s magnezijem i u vatrometima (u bojama srebrna i bijela). Vrlo važan magnezijev spoj je magnezijev hidroksid (Mg (OH)2), koji kada se rasprši u vodi, u koncentraciji od približno 7%, daje poznatu suspenziju popularno kao magnezijevo mlijeko, koje služi kao antacid, boreći se protiv kiselosti u želucu (žgaravica) i kao laksativ.

Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/metais-alcalinoterrosos.htm