Kada se dvije otopine pomiješaju, bez obzira jesu li različite ili ne, potrebno je prvo analizirati postoji li reakcija između njih ili ne. Primjerice, ako otopinu vode pomiješamo sa šećerom (vodena otopina saharoze) i otopinom vode sa soli (salamuri), dobit ćemo miješanje otopina bez kemijskih reakcija.
Isto se događa ako pomiješamo dvije otopine natrijevog klorida (NaCl), s različitim koncentracijama. U ovom slučaju također neće biti reakcije. Tada možemo definirati ovaj primjer kao miješanje otopina iste otopljene tvari, bez ikakve kemijske reakcije, gdje je prvi primjer a miješanje otopina različitih otopljenih tvari, bez kemijske reakcije.
U oba slučaja, kemijski sastav komponenata otopina neće se promijeniti.međutim, neki kvantitativni aspekti morat će se preračunati.
Da bismo razumjeli kako bismo mogli odrediti molarnu koncentraciju (Molarnost) i uobičajenu koncentraciju smjese otopina bez reakcije, pogledajmo razrješenje dva spomenuta slučaja:
1.) Smjesa otopine iste otopljene tvari, bez pojave kemijske reakcije:

Zamislite da pomiješamo dvije otopine natrijevog klorida, jednu s koncentracijom od 2,0 g / L u 60,0 ml otopine, a drugu s 2,5 g / L u 80 ml volumena otopine.
Budući da se reakcija ne događa, i masa i volumen samo su zbroj početnih masa i volumena:
m (rješenje) = m1 (NaCl) + m2 (NaCl)
m1 (NaCl) = v. C m2 (NaCl) = v. Ç
m1 (NaCl) = 0,06 L. 2,0 g / L m2 (NaCl) = 0,08 L. 2,5 g / L
m1 (NaCl) = 0,1 gm2 (NaCl) = 0,2 g
m (otopina) = 0,1 g + 0,2 g
m (otopina) = 0,3 g
v (rješenje) = v1 (NaCl) + v2 (NaCl)
v (otopina) = (60 + 80) ml
v (otopina) = 140 ml = 0,14 L
Tada se koncentracija može dobiti pomoću ovih podataka:
C (rješenje) = m (rješenje)
v (rješenje)
C (rješenje) = 0,3 g
0,14L
C (otopina)≈ 2,14 g / L
2.) Smjesa otopina različitih otopljenih tvari, bez pojave kemijske reakcije:
Uzmimo za primjer smjesu između 500 ml vodene otopine saharoze (C12H22O11) koja je u početku imala koncentraciju 18,0 g / L, s 1 L otopine slane vode (vodena otopina natrijevog klorida - NaCl) s koncentracijom 100,0 g / L.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Nakon miješanja, što su postali molarnost, uobičajena koncentracija, masa i volumen otopine koja je rezultirala iz smjese?
Budući da nije bilo kemijske reakcije, mase C12H22O11 a NaCl ostaju nepromijenjeni. A početne vrijednosti mase mogu se postići jednostavnim pravilom tri pomoću reakcijskih koncentracija.
18,0 g 1 L
m (C12H22O11) 0,5 L
m (C12H22O11) = 9,0 g
m (NaCl) 100,0 g
Masa se također može postići formulom:
m = v. Ç
m (C12H22O11) = 0,5 L. 18g / L
m (C12H22O11) = 9,0 g
m (NaCl) = 1 L. 100,0 g / L
m (NaCl) = 100,0 g
Dakle, ukupna masa otopine zbroj je dviju masa:
m (otopina) = m (C12H22O11) + m (NaCl)
m (otopina) = 109,0 g
Volumen je jednostavno zbroj početnih volumena, pa imamo:
v (konačno rješenje) = v (C12H22O11) + v (NaCl)
v (konačno rješenje) = (0,5 + 1) L
v (konačno rješenje) = 1,5L
Konačna koncentracija postiže se odvojenim izračunavanjem koncentracija svake od otopljenih tvari. Budući da ne reagiraju jedni s drugima i njihove se mase ne mijenjaju, možemo koristiti sljedeću formulu koncentracije:
C = m
v
početno = mpočetni konačni c = mKonačno
vpočetni vKonačno
mpočetni = mKonačno
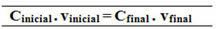
C (C12H22O11) =?
Çpočetni. vpočetni = CKonačno. vKonačno
18,0 g / L. 0,5 L = CKonačno .1,5 L
C (C12H22O11) Konačno = 6,0 g / L
C (NaCl) =?
Çpočetni. vpočetni = CKonačno. vKonačno
100,0 g / L. 1 L = Konačno, 1,5 L
C (NaCl)Konačno = 66,67 g / L
Odnos napravljen za ovu formulu zajedničke koncentracije može se također izvršiti za izračunavanje molarnosti (Mja. vja = Mf. vf) i za koncentraciju u masi po masi (naslov - Tja. vja = Tf. vf).
Napisala Jennifer Fogaça
Diplomirao kemiju