Kloridi su oni ionski spojevi koji sadrže anion Cℓ-1.
Klor je iz obitelji 17 ili 7A, njegov atomski broj jednak je 17 i ima 7 elektrona u valentnoj ljusci (najudaljenijoj elektronskoj ovojnici atoma). Prema Pravilo okteta, da bi bila stabilna, mora imati 8 elektrona u ovoj posljednjoj ljusci i stoga treba primiti još jedan elektron. Kada se to dogodi, odnosno kad primi elektron, općenito, iz ionske veze s metalom, nastaje â.nion klorid (Cℓ-1), metal koji je odustao od elektrona postaje kation, a tvar koja nastaje je ionska.
Kloridi su soli dobivene reakcijom baze s klorovodičnom kiselinom (HCℓ(ovdje)). Baza daje kation, a klorovodična kiselina daje kloridni ion:
Generička baza + klorovodična kiselina → Klorid + Voda
ÇOH + HCℓ → ÇCℓ + H2O
Svi kloridi su klasificirani kao anorganske soli, jer u vodenom mediju oslobađaju kation koji nije H+ i oslobađaju kloridni anion, a ne hidroksil (OH-).
Nomenklatura klorida uvijek slijedi ovo pravilo: Klorid +de + (naziv elementa povezanog s klorom). Na formiraju se vaše formule
zamjenjujući ionske naboje za indekse (broj koji se nalazi u donjem desnom dijelu simbola elementa, označavajući broj prisutnih atoma tog elementa koji stvaraju veze).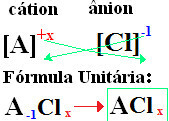
ako indeks je "1", ne trebate ga upisivati u formulu, kao što je prikazano dolje:
Na+1 Cℓ-1 → Na1Cℓ1 → NaCℓ: natrijev klorid;
K+1 Cℓ-1 → KCℓ: kalijev klorid;
Ovdje+2 Cℓ-1→CaCℓ2: kalcijev klorid;
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Ba+2 Cℓ-1→ Bovdje2: barijev klorid;
Aℓ+3 Cℓ-1→ACℓ3: aluminijev klorid.
Međutim, kako je objašnjeno u tekstu “Jonske tvari skupine: klorid, karbonat, nitrat i sulfat”, Kao i kod svih ionskih tvari, kloridi nemaju svoje jedinstvene formule izolirane u prirodi, jer se njihovi ioni međusobno privlače i čine kristalne rešetke.
Glavni primjer klorida koji imamo u svakodnevnom životu je natrijev klorid, NaCℓ, kuhinjska sol. Pogledajte ionsku vezu koja rezultira njenim stvaranjem (u kojoj natrij donira elektron kloru) i ispod kristalne rešetke ove soli:
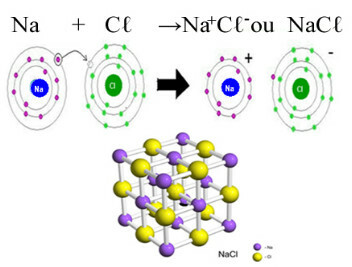
U kristalnoj rešetki natrijevog klorida svaki anion Cℓ- okružen je sa 6 kationa Na+ i obrnuto, pa je koordinacijski broj ove kristalne rešetke 6.
Svi kloridi jesu krutine u ambijentalnim uvjetima i sasvim vodotopljivi, koja je među najčešćim solima pronađenim u našem svakodnevnom životu, s obzirom na to da ih ima nekoliko prisutni su otopljeni u mineralnoj vodi, vodi za piće, vodi iz slavine, rijekama i morima drugi. Iznimka su, u vodi netopivi kloridi, srebreni klorid (AgCℓ - prikazan na sljedećoj slici), iz spojevi olova, bakra i žive.

Srebrni klorid netopiv u vodi *
Ioni Cℓ-1 od klorida koje unosimo, uglavnom u sol, riba i meso, važni su za neke funkcije ljudskog tijela, jer su glavni izvanstanični anion, koji su prisutni u soku želudac, reguliraju tjelesne tekućine, poput raspodjele vode u tijelu, i održavaju osmotski tlak u plazmi i neutralnost električni.
Njegov nedostatak može uzrokovati tjeskobu, proljev i probleme s cirkulacijom. Njegov višak izlučuje se urinom (u prosjeku svaka osoba izluči oko 4 g klorida dnevno), znojem i izmetom.
*Kredit za sliku: Autor: Danny S. / Slika izvučena iz: Wikimedia Commons
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Kloridi"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/cloretos.htm. Pristupljeno 28. lipnja 2021.
Kemija

Svakodnevne soli, kalcijev karbonat, natrijev klorid, natrijev fluorid, kalijev nitrat, natrijev nitrat natrij, natrij karbonat, natrij bikarbonat, natrij bikarbonat, natrij sulfit, šalitra, soda.