Lorenzo Romano Amedeo Carlo Avogadro (1776. - 1856.) bio je talijanski kemičar koji je prvi uspostavio ideju da uzorak elementa, čija je masa u gramima numerički jednaka njegovoj atomskoj masi, uvijek ima jednak broj atoma (N).
Sam Avogadro nije uspio utvrditi vrijednost N. Međutim, tijekom dvadesetog stoljeća, napredak tehnologije i znanstvenih saznanja omogućio je drugim znanstvenicima da razviju tehnike za njegovo određivanje. Kad je ta vrijednost konačno otkrivena, pozvana je Avogadrova konstanta, u čast ovog znanstvenika, jer je upravo on postavio temelje za njegovo stvaranje.

Lorenzo Romano Amedeo Carlo Avogadro (1776.-1856.)
U 1 molu bilo kojeg entiteta (atomi, molekule, elektroni, formule ili ioni) sadržana je točno vrijednost Avogadrove konstante.
Tablica u nastavku prikazuje neke vrijednosti Avogadrove konstante dobivene tijekom 20. stoljeća:
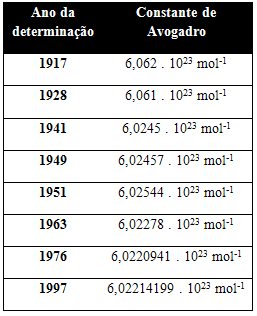
Evo nekoliko tehnika kojima se pokušava utvrditi vrijednost Avogadrove konstante:
Prvi znanstvenik koji je napravio približni izračun Avogadrove konstante bio je Johann Joseph Loschmidt. 1867. utemeljio se na kinetičkoj teoriji plinova i utvrdio koliko molekula postoji u 1 cm
3 plina.Drugi od tih znanstvenika bio je Francuz Jean Baptiste Perrin (1870.-1942.) Koji je brojao broj koloidnih čestica po jedinici volumena u suspenziji i mjerio njihove mase. Vrijednost koju je pronašao bila je između 6,5 i 7,2. 1023 entiteta po mol. Ovaj je znanstvenik objavio knjigu 1913. godine Les Atomes (1. izd. Pariz: Alcan), a njegovo je 9. izdanje, objavljeno 1924. godine, sadržavalo 16 načina za eksperimentalno dobivanje Avogadrove konstante.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)

Jean Baptiste Perrin (1870.-1942.)
Godinama kasnije, znanstvenik James Dewar (1842-1923) koristio se metodom koju su godinama ranije razvili radiokemičar Bertram Boltwood (1870-1927) i fizičar Ernest Rutherford (1871.-1937.), Koji se u osnovi sastojao od brojanja alfa čestica koje emitira radioaktivni izvor i određivanja volumena dobivenog plina helija. Vrijednost koju je pronašao Dewar bila je 6,04. 1023 mol-1.
Još u 20. stoljeću Robert Millikan (1868. - 1953.) izveo je eksperiment za određivanje naboja elektrona (1.6. 10-19 Ç). Kako je naboj od 1 mola elektrona već bio poznat (96500 C), bilo je moguće povezati ove dvije vrijednosti i pronaći sljedeću vrijednost za Avogadrovu konstantu: 6.03. 1023 mol-1.
Trenutno je preporučena vrijednost za Avogadrovu konstantu 6,02214 x 1023 mol-1 a određuje se pomoću difrakcije rendgenskih zraka, u kojoj se dobiva volumen nekoliko atoma kristalne rešetke, sve dok je poznata gustoća i masa 1 mola atoma u uzorku.
U didaktičke svrhe, u srednjoj školi, gdje izračuni ne trebaju biti točni kao oni koji se izvode u kemijskim laboratorijima, Avogadrova konstanta smatra se 6,02. 1023 mol-1.
Postoje i jednostavnije metode koje se studentima mogu pomoći u određivanju Avogadrove konstante u praksi. Jedan od njih je elektrolizom u vodenom mediju.
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Određivanje Avogadrove konstante"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm. Pristupljeno 28. lipnja 2021.


