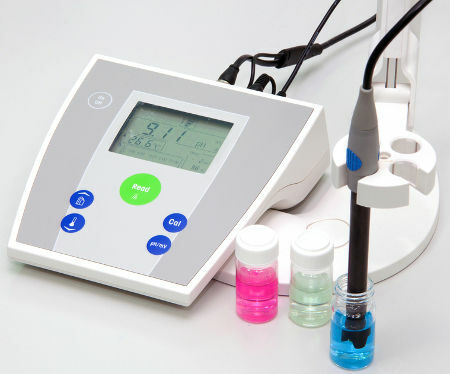
pH predstavlja ionski potencijal vodika, a pOH je hidroksi-ionski potencijal otopina.
To su logaritamske skale koje se koriste za mjerenje kiselog i baznog karaktera uzorka.
Vrijednosti koje ih čine kreću se od 0 do 14, a dobivene su iz ionske ravnoteže vode.
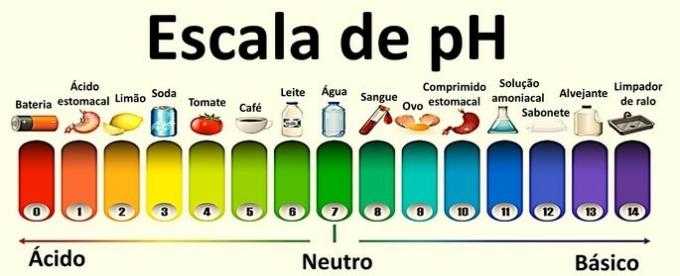
Neutralna otopina ima pH 7. Vrijednosti ispod 7 otopine klasificiraju kao kisele, dok su nakon 7 otopine osnovne.
S pH vrijednošću moguće je pronaći odgovarajuću na skali pOH, samo oduzimanjem.
Jonska bilanca vode
Molekula vode ima sposobnost ioniziranja prema jednadžbi:
Ovdje imamo ionsku ravnotežu, jer je proces reverzibilan i ioni se također mogu spojiti i ponovno stvoriti molekulu vode.
Drugi način da se pokaže ravnoteža koja se događa je putem autoionizacija.
Molekula vode generirala je hidronijeve ione (H3O+) i hidroksil (OH-) kroz poremećaj druge molekule.
Jonski proizvod vode (Kw)
Konstanta za ionsku ravnotežu vode je:
Kako je voda čista tekućina, njena koncentracija se uzima kao 1 i ne ometa konstantnu vrijednost. Stoga izraz postaje:
O ionski proizvod od Voda é .
Ovaj izraz dobiva simbol Kw (W dolazi od engleske riječi water - voda) i poput konstante ravnoteže, ona varira s temperaturom.

Određivanje pH i pOH
Na temperaturi od 25 ° C, ionski proizvod vode je:
U ionizaciji čiste vode 1 mol H3O+ nastaje s 1 mol OH- .
Uskoro,
Kako su ove vrijednosti izuzetno niske, odlučeno je koristiti vrijednosti kologaritama, koji odgovaraju logaritmu sa zamijenjenim predznakom.
Primjenjujući kologaritam na ionski produkt vode, moramo:
Možemo primijetiti da: ako znamo pH otopine, vrijednost pOH možemo pronaći oduzimanjem prve vrijednosti od 14.
Kiselost i osnovnost otopina
Neutralno rješenje: koncentracija hidronijevih iona jednaka je koncentraciji hidroksila.
| [H3O+] = 1,0. 10-7 mol / L | pH = 7 |
| [Oh-] = 1,0. 10-7 mol / L | pOH = 7 |
Primjer: čista voda.
otopina kiseline: koncentracija hidronijevih iona veća je od koncentracije hidroksila.
| [H3O+] |
pH |
| [Oh-] |
pOH |
Primjer: soda, limun i rajčica.
osnovno rješenje: koncentracija hidroksila veća je od koncentracije hidronijevih iona.
| [H3O+] |
pH |
| [Oh-] |
pOH |
Primjer: jaje, sapun i izbjeljivač.
izračun pH
Koncept hidrogenih potencijala stvorio je danski kemičar Peter Lauritz Sorensen (1868.-1939.) Kako bi izrazio kiselost otopine koncentracijom H+.
Pogledajte donju tablicu koja pokazuje ionizaciju a kiselina:
| Početna molarnost | 0,020 | 0 | 0 |
| ionizacija | 0,001 | 0,001 | 0,001 |
| Molarnost u ravnoteži | 0,019 | 0,001 | 0,001 |
U primjeru imamo da je koncentracija H iona+ é 0,001. Stoga je pH otopine:
[H+] = 0,001 = 10-3
pH = - log 10-3 = 3
Kako je pH otopine manji od 7, ta je otopina kisela.
Sažetak o pH i pOH
| Definicije | pH: vodikov ionski potencijal otopine. | |
|---|---|---|
| pOH: hidroksilni potencijal otopine. | ||
| opća formula | pH + pOH = 14 | |
| Rješenja | Neutralno | pH = pOH = 7 |
| kisela |
pH pOH> 7 |
|
| osnove |
pOH pH> 7 |
|
| izračun pH | pH = - log [H+] | |
| Izračun pOH | pOH = -log [OH-] |
Vježbe na pH i pOH
1. (FMTM) pH želučanog soka, vodene otopine klorovodične kiseline (HCℓ), približno je 2. Stoga je masa HCℓ, koja postoji u svakoj litri želučanog soka, u gramima
Podaci: Molarne mase (g / mol) H = 1, Cℓ = 35,5
a) 7,3 · 10-2
b) 3,65 · 10-1
c) 10-2
d) 2
e) 10
Točna alternativa: b) 3,65 · 10-1.
1. korak: izračunati koncentraciju H iona+.
2. korak: izračunati molarnu masu HCl.
3. korak: izračunajte masu klorovodične kiseline u svakoj litri želučanog soka.
2. (UEMG) Nekoliko proizvoda za čišćenje sadrži amonijak. Oznaka jednog od ovih proizvoda označava pH = 11. To znači da su koncentracije hidroksonijevih kationa i hidroksilnih aniona u ovom proizvodu:
do 1. 10-3 i 1. 10-11
b) 1. 10-11 i 1. 10-7
c) 1. 10-11 i 1. 10-3
d) 1. 10-11 i 1. 10-11
Ispravna alternativa: c) 1. 10-11 i 1. 10-3.
a) POGREŠNO. Te koncentracije odgovaraju otopini pH = 3.
b) POGREŠNO. Iako je koncentracija H+ pokazuju da je pH otopine 11, koncentracija OH iona- je pogrešno, jer bi trebalo biti 3, budući da je: pOH = 14 - pH.
c) TOČNO. pH = 11 i pOH = 3, budući da je pH + pOH = 14.
d) POGREŠNO. Iako je koncentracija H+ pokazuju da je pH otopine 11, koncentracija OH iona- je pogrešno, jer bi trebalo biti 3, budući da je: pOH = 14 - pH.
a) 0,1 mol / L NaOH
b) NaCl 0,5 mol / L
CH2SAMO4 1,0 mol / L
d) 1,0 mol / L HCl
e) 0,2 mol / L KOH
Točna alternativa: e) KOH 0,2 mol / L.
a) POGREŠNO. Otopina je osnovna jer joj je pH veći od 7, ali nema viši pH od drugih.
b) POGREŠNO. NaCl je sol jer je proizvod jake kiselinske i bazne reakcije. Stoga je njegov pH neutralan.
c) POGREŠNO. Sumporna kiselina je jaka kiselina, pa joj je pH nizak.
d) POGREŠNO. Klorovodična kiselina je jaka kiselina, pa joj je pH nizak.
e) TOČNO. Otopina je osnovna jer joj je pH veći od 7.