O Thomsonov atomski model je 1898. godine predložio engleski fizičar Joseph John Thomson ili, jednostavno, J. J. Thomson. Nakon što ih je imao nekoliko eksperimentalni dokaz o postojanju elektrona, prevrnuo je teoriju nedjeljivosti atoma koju je predložio John Dalton.
Thomson je na temelju svog modela potvrdio i dokazao postojanje elektroni (čestice s negativnim električnim nabojem) u atomu, odnosno atom ima subatomske čestice.
Mapa uma: Atomski model Thomson
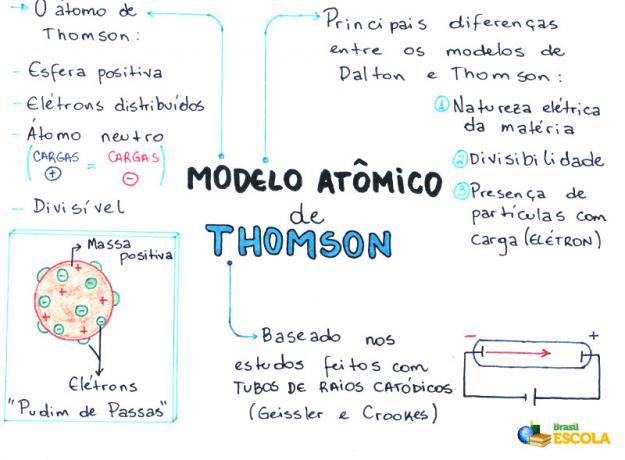
* Za preuzimanje mape uma u PDF-u, Kliknite ovdje!
Thomson je predložio svoj atomski model na temelju otkrića povezanih s radioaktivnošću i eksperimenata izvedenih s katodnom cijevi koju su izgradili znanstvenici Geissler i Crookes. Pogledajte prikaz ove cijevi:
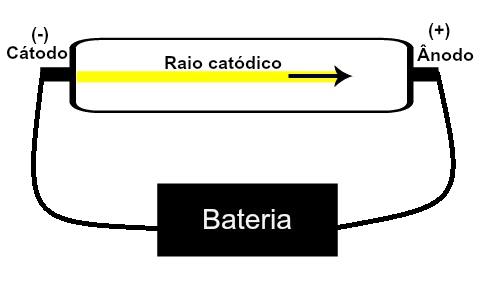
Kad je razrijeđeni plin pod niskim tlakom izložen visokom električnom naponu (npr. 15000 V), on stvara a snop svjetlosti (sastavljen od električnih naboja) od katode (negativni pol) prema anodi (pol pozitivan).
Ovim pokusom Thomson je došao do zaključka da kada se atomi plinovitog materijala nalaze unutra cijevi bili podvrgnuti visokom naponu, njihovi su elektroni istrgnuti i usmjereni na ploču pozitivan.
Razmatranja koja je predložio Thomson-ov atomski model
Pokusima izvedenima s katodnom cijevi, Thomson je predložio svoje tumačenje kako bi atom i njegova građa bili. Prema njemu:
- Atom je sfera, ali nije masivan kako je predložio John Dalton atomski model;
- Atom je neutralan, jer je sva materija neutralna;
- Kako atom ima elektrone koji imaju negativne naboje, stoga mora imati pozitivne čestice tako da konačni naboj bude nula;
- Elektroni nisu fiksirani ili zarobljeni u atomu, oni se pod određenim uvjetima mogu prenijeti na drugi atom;
- Atom se može smatrati kontinuiranom tekućinom s pozitivnim nabojima u kojoj bi bili raspoređeni elektroni koji imaju negativan naboj;
- pridružio vaš model na puding od grožđica (koji predstavljaju elektrone);
- Kako raspršeni elektroni imaju isti naboj, među njima postoji međusobna odbojnost, što ih čini ravnomjerno raspoređenim u sferi.
Novosti koje je atom predložio Thomsonovim modelom
Thomson-ov atomski model bio je drugi predloženi za atom. Prvi model formulirao je John Dalton.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Thomsonov model bavio se novim saznanjima o atomu koja do tada nisu bila predložena zbog nedostatka znanstvene osnove, kao što su:
- Električna priroda materije;
- Rascjepljenost atoma;
- Prisutnost malih, nabijenih čestica u atomu.
Problemi ukazani na atom Thomson
Nekoliko fizičara u vrijeme prijedloga Thomsonov atomski model, temeljen na teorijama klasične fizike, ukazao je na neke nedosljednosti prisutne u ovom modelu:
- Thomson je sugerirao da atom ima stabilnost u odnosu na jednoliku raspodjelu elektrona, koja se može modificirati utjecajem energije. Međutim, klasična fizika, temeljena na elektromagnetizam, ne dopušta postojanje stabilnog sustava koji se temelji samo na odbijanju između čestica istog naboja;
- Za Thomsona su elektroni ravnomjerno raspoređeni u atomu, ali imaju sposobnost pomaknuti se ubrzanim načinom i stoga moraju emitirati elektromagnetsko zračenje na određenim frekvencijama specifično. Međutim, to nije primijećeno.
- Thomsonov model često je bio neučinkovit u objašnjavanju atomskih svojstava, poput njihovog sastava i organizacije.
* Mind Map Victora Ricarda Ferreire
Učitelj kemije
Ja, Diogo Lopes Dias
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
DANI, Diogo Lopes. "Thomson-ov atomski model"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/o-atomo-thomson.htm. Pristupljeno 27. lipnja 2021.
Kemija

Niels Bohr, Bohrov atom, atomska fizika, stabilni atom, atomski model, planetarni sustav, slojevi elektrosfere, razine energije, elektronske ljuske, energija elektrona, Rutherfordov atomski model, atom pobuđenog stanja.
Kemija

Atomi i konstrukcija svemira, atomska teorija, da je sve napravljeno, materiju čine atomi, teorija četiri elementa, drevni alkemičari, atomska teorija, temeljna čestica.
