Vas Ugljikovodici sastavljeni su od ugljik (C) i vodik (H). Fleksibilnost ugljika, koji je glavni element ovih spojeva, pogoduje postojanju velike raznolikosti struktura Stoga se neka svojstva, poput točke taljenja i vrelišta, mogu razlikovati između pojedinih ugljikovodika.
Uglavnom su molekule apolar, sa snagas intermolekularni inducirani dipolni tip i gustoća manja od The iz vode. Identifikacija ovih spojeva može se izvršiti putem nomenklature koja slijedi pravila uspostavljena od strane Međunarodne unije za čistu i primijenjenu kemiju (Iupac).
Pročitajte i vi: Ugljik - jedan od najzastupljenijih elemenata u svemiru
Svojstva ugljikovodika

Polaritet: ugljikovodici bez prisustva heteroatoma su apolar.
Intermolekularne sile: veze između molekula ugljikovodika su tog tipa inducirani dipol.
talište i iključanje: oni se razlikuju prema veličini, funkciji i strukturnoj organizaciji molekule.
psihičko stanje: u normalnim uvjetima temperature i tlaka, ugljikovodici s četiri ili manje atoma ugljika nalaze se u plinovitom stanju. Oni s 5 do 17 ugljika su u tekućem stanju, a ugljikovodici s više od 17 ugljika su čvrste tvari.
Gustoća: je manji od gustoća vode, odnosno manje od 1,0 g / cm3.
Reaktivnost: alifatski i nezasićeni ugljikovodici slabo su reaktivni; nezasićeni spojevi vjerojatnije će reagirati s drugim molekulama, a ciklički ugljikovodici s do pet ugljika vrlo su reaktivni.
Klasifikacija ugljikovodika
Ugljikovodici mogu se klasificirati prema strukturnoj organizaciji lanca i po ustanovama.Nezasićenja prisutnost dvostruke (ih) ili trostruke veze između ugljika, je pojava priključci tipa pi (π). već ono grane oni su poput "grana" pričvršćenih za veću strukturu ugljikovodika. Ciklični lanci također mogu sadržavati grane i / ili nezasićenja - strukturna organizacija ugljikovodika zatvorenog lanca tvori poligone poput kvadrata, trokuta, heksana, između ostalog.
Što se tiče rasporeda atoma, ugljikovodik može imati normalan ili razgranat lanac.
→ C ugljikovodiknormalna, linearna ili ravna crta: onaj sa nizom koji ima samo dva kraja.

→ C ugljikovodikmrzi razgranati: onaj s lancem koji ima više od dva kraja. Da biste znali gdje su i koje su grane, važno je pravilno odabrati glavni lanac. Glavni lanac mora sadržavati sve nezasićenja i heteroatome (ako postoje), kao i najveći broj sekvencijalnih ugljika. Ugljikovi koji nisu sadržani u glavnom lancu su grane.
Primjer:

S obzirom na svoje "zatvaranje", ugljikovodik može imati zatvoreni, otvoreni ili miješani lanac.
→ Lančani ugljikovodicis zatvoreno ili ciklično: oni s lancima u kojima se atomi organiziraju tvoreći ciklus, poligon ili aromatski prsten (zatvoreni ugljikovodik s izmjeničnim nezasićenjima). Nemojte imati labave krajeve, osim ako nema grane. Svaki vrh poligona predstavlja ugljik i njegova odgovarajuća vodikova veziva.
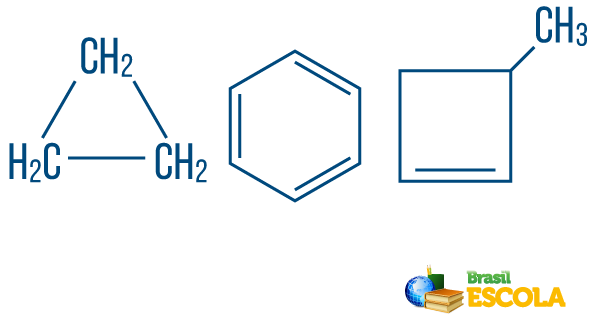
→ Otvoreni lanac ili aciklički ugljikovodici: su oni s lancima koji imaju najmanje dva kraja.

→ Ugljikovodik od niz mješovitog tipa: tvori prsten ili ciklički lanac pričvršćen na linearni dio; ima barem jedan kraj.
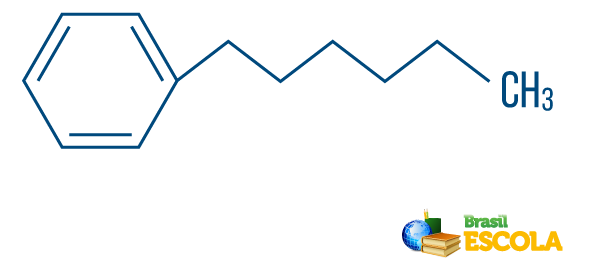
Pročitajte i vi: Aromatski ugljikovodici - primjeri i svojstva
Nomenklatura ugljikovodika
Za svaku vrstu ugljikovodika postoji pravilo imenovanja koje je uspostavio Iupac. Nomenklatura ovih spojeva izrađena je kako slijedi:
1. dio: mjesto i naziv podružnice (ako postoje);
2. dio: izraz se odnosi ciklus ako je spoj zatvoreni lanac, ali ako je alifatski (otvoreni) lanac, neće biti potreban;
3. dio: prefiks koji pokazuje koliko ugljika ima u glavnom lancu;
4. dio: mjesto i infiks koji ukazuju na vrstu nezasićenja u molekuli;
5. dio: sufiks "o" svojstven ugljikovodicima.
Ako molekula ima otvorenu strukturu, bez grananja, nomenklatura će započeti u 3. dijelu.
Sljedeća tablica prikazuje potrebne podatke (prefiks, infiks i sufiks) za ugljikovodikovu nomenklaturu općenito. O prefiks varira s brojem ugljika; O infix, prema broju nezasićenja; to je sufiks“O " "karboksil" odnosi se na spojeve tipa ugljikovodika.
Prefiks |
Infiks |
Sufiks |
||
1 ugljik |
sreo- |
Samo pojedinačni pozivi |
-an- |
-O |
2 ugljika |
et- |
|||
3 ugljika |
podupirati |
1 dvostruka veza |
-en- |
|
4 ugljika |
ali- |
|||
5 ugljika |
zadržan- |
2 dvostruke veze |
-dien- |
|
6 ugljika |
hex- |
|||
7 ugljika |
hept- |
1 trostruka veza |
-u- |
|
8 ugljika |
okt- |
|||
9 ugljika |
ne- |
2 trostruke veze |
-diin- |
|
10 ugljika |
dec- |
Prvi korak u otkrivanju nomenklature organskog spoja je identificirati glavni lanac ugljika, koji mora sadržavati nezasićenja i što više uzastopnih ugljika. Nakon identificiranja glavnog lanca, ugljik mora biti nabrojan - započinjanje brojanja sa strane najbliže granama i nezasićenja (ako ih ima). THE lokalizacija bit će broj ugljika u kojem je pronađena grana ili nezasićenje. Ponekad postoji samo jedno moguće mjesto radikalne ili dvostruke ili trostruke veze, tako da nije potrebno izraziti mjesto veznog ugljika u nomenklaturi.

THE nomenklatura za grane dat će se brojem ugljika u svakom, plus završetak crta ili ll. Kad postoji više grana, koristi se abecedni redoslijed.
Pogledajte primjere u nastavku:
→ Primjer 1
CH3 - CH2 - CH3 → Propan
1. dio: prefiks „podupirati”Označava da lanac ima tri ugljika.
2. dio: infiks "-an-”Signalizira da molekula uspostavlja samo veze tog tipa sigma ili jednostavno.
3. dio: sufiks "-O”Karakteristično je za ugljikovodike.
→ Primjer 2
CH2= CH-CH2-CH3 → Ali-1-en
U ugljikovodicima s nezasićenom površinom potrebno je numerirati i locirati ugljik u kojem se par nalazi, a numeriranje mora biti što manje. U tu svrhu, broj ugljika mora započeti sa stranicom koja je najbliža dvostrukoj vezi.
1. dio: "ali-" označava da su u lancu četiri ugljika.
2. dio: "1-hr" Izraz "nezasićenje" nalazi se između ugljika 1 i 2.
3. dio: "-O" karakterističan je sufiks ugljikovodika.
→ Primjer 3

1. dio: "3-etil" signalizira da na ugljiku 2 postoji grana od dva ugljika.
2. dio: "-pent-" označava prisutnost pet ugljika u glavnom lancu.
3. dio: "-an-" je infiks primijenjen na nezasićene lance (bez dvostrukih ili trostrukih veza).
4. dio: "-O" karakterističan je sufiks ugljikovodika.
→ Primjer 4
Za lance sa više grana, smjestite radikale u nomenklaturu abecednim redom. Ako u istoj molekuli postoje grane i nezasićenja, brojanje ugljika u glavnom lancu treba izvršiti na takav način da zbroj brojeva mjesta bude što manji.
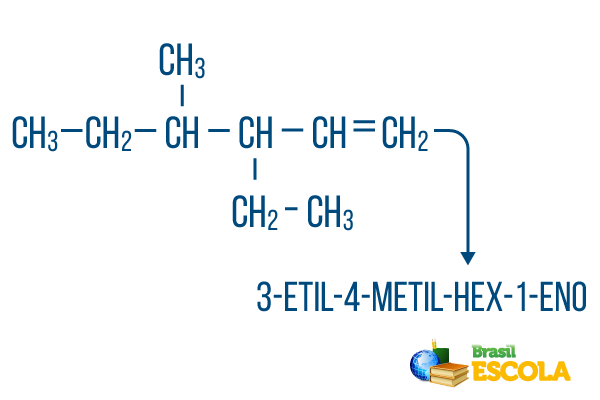
Brojanje ugljika u glavnom lancu izvršeno je slijeva udesno, a zbroj brojeva nezasićenja i mjesta grana iznosi: 1 + 4 + 3 = 8. Da je broj ugljika bio zdesna nalijevo, složena nomenklatura bila bi 4-etil-3-metil-5-en, čiji bi zbroj lokacija bio: 4 + 3 + 5 = 12, što je veće od druge hipoteze, pa se ne bi trebao koristiti.
1. dio: 3-etil-4-metil upućuje na radikale abecednim redom i na njihova mjesta.
2. dio: hex- znači da u glavnom lancu ima 6 ugljika.
3. dio: 1-hr označava prisutnost dvostruke veze na ugljiku 1.
4. dio: "-O" karakterističan je sufiks ugljikovodika.
→ Primjer 5
Za zatvorene nizove vrijede pravila imenovanja, ali riječ ciklus započinje naziv spoja, naznačujući da je riječ o zatvorenom ili cikličkom ugljikovodiku.
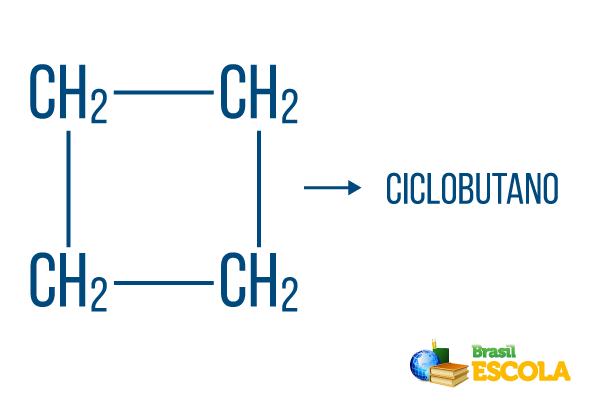
1. dio: ciklus- označava da je to zatvoreni niz.
2. dio: -ali- označava postojanje 4 ugljika u lancu
3. dio: -Okarakterističan je sufiks ugljikovodika.
Pročitajte i vi: Klasifikacija ugljikovih lanaca
Vrste ugljikovodika
Ugljikovodici se mogu podijeliti na alkane, alkene, alkine i alkadiene - koji se klasificiraju kao prema uspostavljanju lanca (dvostruke (e) ili trostruke veze) - i ciklani, koji su lanci zatvoreno.
→ Alkani: su ugljikovodici koji nemaju nezasićenje. Opća formula za alkane je CNeH2n + 2, i Nepredznak to je sastavio prefiks + an + O.
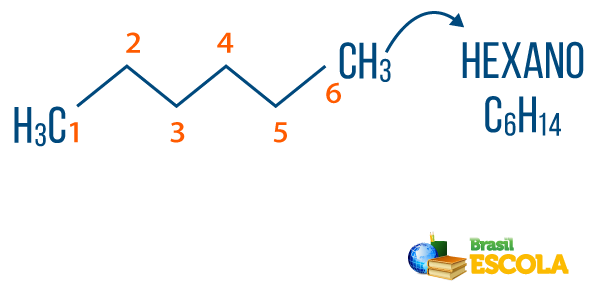
Vas alkani mogu se naći u prirodi, poput benzina metan (CH4), koju životinje oslobađaju i proizvode u procesima razgradnje, kao i u rafinerijama i petrokemijskoj industriji. Spojevi poput propan (Ç3H7), butan (Ç4H10), koji čini naš plin za kuhanje (LPG), i oktan (Ç8H18), prisutni u automobilskom gorivu, nusproizvodi su Nafta.

→ alkeni ili alkeni: su ugljikovi lanci koji imaju nezasićenje, dvostruku vezu. Njegova opća formula je CNeH2n, i tvoje Nepredznak to je sastavio Strpopraviti + en + o.

O plin etilen (Ç2H4), koji se u poljoprivredi koristi za ubrzanje sazrijevanja plodova, pripada toj funkciji alken. Spoj se također koristi u proizvodnji sirovina polietilen, koji se koriste u proizvodnji posuđa od plastike.
→ Alkini ili acetilenski: ugljikovodici s trostrukom vezom. Njegova opća formula je CNeH2n - 2. THE nomenklatura to je sastavio prefiks + u + o.

O acetilen ili etin (C2H2) je plin alkinske funkcije koji se koristi u zavari i metalni rezovi. Ovaj spoj može doseći temperature do 3000 ° C, što omogućuje popravak na potopljenim dijelovima broda.

→ alkadijeni ili dieni: ugljikovi lanci s dvije nezasićenja, odnosno dvije dvostruke veze između ugljika. Opća formula za ovu funkciju je C.NeH2n - 2. Shvatite da je to ista formula kao i alkini, što znači da se to može dogoditi izomerizam između spojeva (ista molekulska formula za različite spojeve).
Nomenklatura alkadiene sastoji se od Strpopraviti + dien + o.
Primjer:

→ Ugljikovodici zatvorenog lanca: molekule se organiziraju na cikličan način, imaju tendenciju da tvore poligon i, kao u otvorenim lancima, mogu postojati postrojenja i / ili posljedice. Cikloni, cikloni, ciklini i benzeni su ugljikovodici zatvorenog lanca.
Cikloni ili cikloalkani: ciklički lanci koji se sastoje samo od jednostrukih veza. Njegova opća formula je CNeH2n. Nomenklatura: ciclo + prefiks + an + o.
Ciklusi ili cikloalkeni: zatvoreni lanci ugljikovodika s pogonom. Njegova opća formula je CNeH2n-2. Nomenklatura: çiclo + prefiks + en + O.
-
Ciklini ili cikloalkini: ugljikovodici zatvorenog lanca uz prisustvo dvije dvostruke veze. Njegova opća formula je CNeH2n-4. Nomenklatura: çiclo + prefiks + u + o.
benzeni
Benzen je vrsta ugljikovodika zatvorenog lanca sa šest ugljika gdje se veze razlikuju između jednostrukih i dvostrukih. Ti spojevi su otrovno i vrlo kancerogen, upotrebljava se kao organsko otapalo u kemijskim procesima.
Da bi se ugljikovodik mogao smatrati aromatičnim, mora postojati barem jedan benzenski prsten, koji je visoko reaktivan, pa podliježe dvjema ili više zamjene, što ćemo ovdje vidjeti kao posljedice. Kad postoje dva radikala koja povezuju, imat ćemo određena imena za svaki par položaja.
Radijali na 1,2 ugljika benzena → orto
Radikali na 1,3 ugljika benzena → cilj
Radijali na ugljiku 1,4 benzena → za
Anomenklatura aromatskog spoja vrši se na sljedeći način:
1. dio: pozicioniranje liganada (orto, cilj ili to).
2. dio: naziv radikala ili radikala vezanih za benzen (metil, etil, propil ...). Ime radikala slijedi pravilo ostalih ugljikovodika.
- 3. dio: -BOtrov, što je karakterističan pojam aromatskih ugljikovodika.
Primjeri:
→ Orto-dimetil-benzen

1. dio: Orto- označava da su radikali smješteni na ugljiku 1 i 2.
2. dio: -dimetil- Odnosi se na dva radikala, oba s jednim ugljikom.
3. dio: -benzen je karakterističan pojam za aromatske ugljikovodike.
→ Orto-etil-metil-benzen
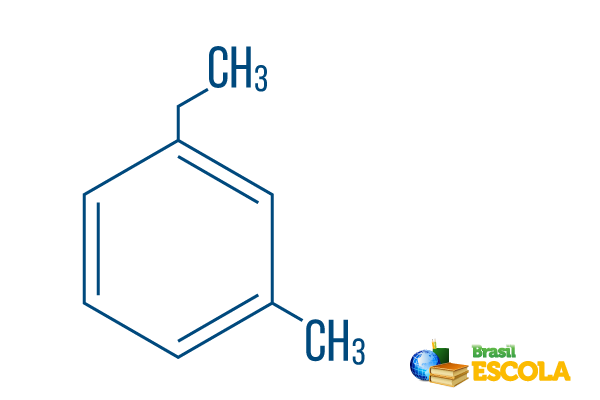
1. dio: mOh- označava da su radikali smješteni na ugljiku 1 i 3.
2. dio: etil-metil- Odnosi se na količinu ugljika u svakom radikalu, tj etil The dvokarbonska grana i metil grananje s jednim ugljikom - smješteno u nomenklaturu abecednim redom.
3. dio: -benzen je karakterističan pojam za aromatske ugljikovodike.
→ para-dietil-benzen
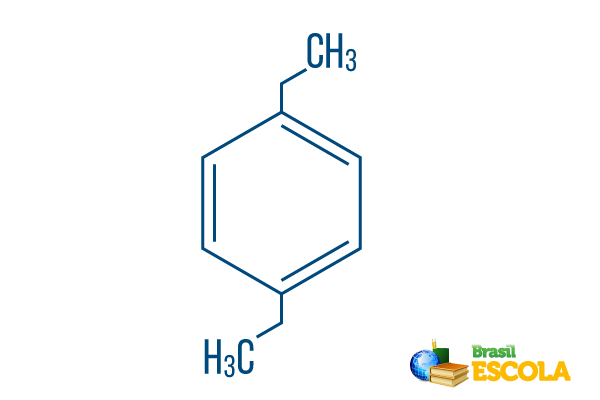
1. dio: Strplug- ukazuje da su radikali na ugljiku 1 i 4 benzena.
2. dio: -dietil- upućuje na dva radikala tog tipa etil, odnosno dvije grane sa po dva ugljika.
3. dio: -benzen je karakterističan pojam za aromatske ugljikovodike.
Pročitajte i vi:Otkriće strukture benzena
riješene vježbe
(Unesp) - Oktan je jedan od glavnih sastojaka benzina, koji je smjesa ugljikovodika. Molekulska formula oktana je:
a) C8H18
b) C8H16
c) C8H14
d) C12H24
e) C18H38
Odgovor: slovo a). Analizirajući složenu nomenklaturu oktan, to je alkan, odnosno molekula koja se sastoji samo od jednostrukih veza. Ako je opća formula za alkane CNeH2n + 2, zamjenjujući "n" sa osam, što je količina ugljika u glavnom lancu - i jedinstvena u ovom slučaju -, imat ćemo da je molekularna formula oktana C8H18.
(UFSCar-SP) - Razmotrite sljedeće izjave o ugljikovodicima.
I) Ugljikovodici su organski spojevi koji se sastoje samo od ugljika i vodika.
II) Samo nezasićeni ugljikovodici ravnog lanca nazivaju se alkeni.
III) Cikloalkani su zasićeni alifatski ugljikovodici opće formule CnH2n.
IV) Jesu li aromatski ugljikovodici: bromobenzen, p-nitrotoluen i naftalen.
Sljedeće su izjave točne:
a) samo I i III.
b) samo I, III i IV.
c) samo II i III.
d) samo III i IV.
e) samo I, II i IV.
Odgovor: Slovo a).
II - Alkeni su spojevi s dvostrukom vezom, odnosno nezasićeni, ali u svom lancu mogu imati posljedice, a ne isključivo linearne.
IV - Brometobenzen i p-nitrotoluenski spojevi pripadaju drugima organske funkcije.
Laysa Bernardes
Učitelj kemije
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/hidrocarbonetos.htm
