Ono što dokazuje reakciju je transformacija koja se događa u tvarima u odnosu na njihovo početno stanje, te modifikacije ovise o vrsti reakcije kroz koju će reaktanti proći.
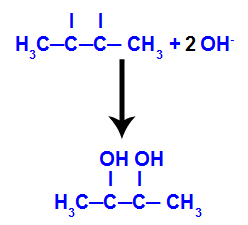
Postoji nekoliko kriterija za klasificiranje kemijskih reakcija, jedan od njih odnosi se na broj tvari koje reagiraju (reaktanti) i broj proizvedenih tvari (proizvodi). Za bolju ilustraciju poslužit ćemo se slovima: THE, B, Ç, x, Y.
Reakcija sinteze ili adicije: su oni u kojima dvije ili više tvari potječu iz jednog proizvoda.
A + B → Ç
Primjer ove reakcije: kada magnezij reagira s kisikom u zraku:
2Mg (s) + 1 O2(g) → 2MgO (s)
Ova reakcija prisutna je u fotografskim bljeskovima za jednokratnu upotrebu i signalnim raketama.
Reakcija analize ili razgradnje: u ovoj reakciji jedna tvar stvara dva ili više proizvoda.
THE → B + C
Neke reakcije dobivaju posebna imena:
Elektroliza: tvari se raspadaju prolaskom električne struje.
Fotoliza: kemijska razgradnja svjetlošću.
Piroliza: razgradnja djelovanjem topline i vatre.
Primjer: Zračni jastuci su sigurnosni uređaji prisutni u mnogim automobilima. Kada pokrenemo ovaj uređaj, brza razgradnja natrijeva spoja NaN
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
2 NaN3(s) → 3 N2(g) + 2 Na (s)
Jednostavna reakcija izmjene ili istiskivanja: javlja se kada jednostavna tvar reagira sa spojem, stvarajući nove tvari: jednu jednostavnu i jednu smjesu.
A + XY → Y + X
Primjer: Kad se list cinka uvede u vodenu otopinu klorovodične kiseline, stvorit će se cinkov klorid i oslobodit će se plinoviti vodik.
Zn (s) + 2 HCl (vod.) → ZnCl2(vodeno) + H2 (g)
Imajte na umu da je cink istisnuo vodik, pa otuda i naziv "reakcija istiskivanja".
reakcija dvostruke izmjene: dva reagensa reagiraju tvoreći dva proizvoda, tj. ako dvije složene tvari reagiraju dajući nove složene tvari, dobivaju ovaj naziv.
AB + XY → Y + XB
Primjer: Reakcija između sumporne kiseline i barijevog hidroksida stvara vodu i barijev sulfat.
H2SAMO4 (aq) + Ba (OH)2(vod.) → 2 H2O (1) + BaSO4(s)
Proizvod barijevog sulfata: BaSO4(s) je netopiva bijela sol.
Napisala Líria Alves
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
SOUZA, Líria Alves de. "Vrste kemijskih reakcija"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/tipos-reacoes-quimicas.htm. Pristupljeno 27. lipnja 2021.