Znanstvenik Friedrich Kohlrausch (1840.-1910.) Prvi je predložio da čista voda provodi električnu energiju, iako u malom mjerilu. To je zato što se voda ponaša amfoterno; to jest, u određenim prilikama djeluje poput kiseline, donirajući protone (H+); a u drugima se ponaša kao baza primajući protone.
To znači da voda vrši vlastitu ionizaciju, prema kemijskoj jednadžbi prikazanoj dolje:
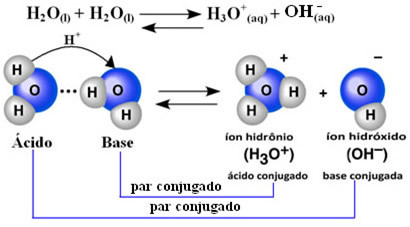
Taj se proces naziva autoionizacija vode i javlja se u vrlo malom opsegu, odnosno voda je vrlo slab elektrolit, s malim vrijednostima stupnja ionizacije i ionizacijske konstante u ravnoteži (Kç). Upravo je to razlog zašto voda ima tako malu vodljivost.
Da bismo stekli ideju, pri sobnoj temperaturi od 25 ° C moguće je utvrditi da su koncentracije hidroksida i hidronijevih iona nastalih u samionizaciji čiste vode jednake 1. 10-7 mol. L-1. To znači da se od milijardu molekula vode samo dvije ioniziraju.
Konstanta ionske ravnoteže vode naziva se çkonstanta disocijacije vode,konstanta autoprotolizeili ionski proizvod vode.Ovu konstantu predstavlja Kw, jer se w odnosi na riječ voda, što na engleskom znači voda.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Njegov se izračun vrši na isti način kao i ostale konstante ravnoteže, sjećajući se toga, kako je navedeno u tekstu "Konstante Balans Kc i Kp ”, u ovom će se slučaju u izrazu pojaviti samo proizvodi, jer voda u tekućem stanju ima istu aktivnost do 1. Čiste tekuće ili krute tvari ne stavljaju se u konstantni izraz disocijacije jer se ne mijenjaju. Stavljaju se samo vodene i plinovite otopine. Tako imamo:
Kw = [H3O+]. [Oh-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
Kao i kod ostalih konstanti ravnoteže, u reduw mijenja se samo s promjenom temperature. Kako se temperatura vode povećava, tako se povećava i njena ionizacija, što znači da je samoionizacija vode endotermni proces, odnosno ona upija toplinu.
To se može vidjeti u ionskim vrijednostima proizvoda vode (Kw) dani u donjoj tablici pri različitim temperaturama:
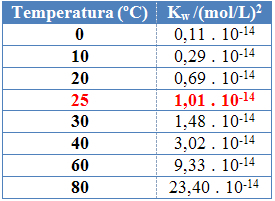
Jonski proizvod vode uvijek će imati fiksnu vrijednost pri svakoj temperaturi, bilo u čistoj vodi ili u otopini. Čak i ako otopina ima koncentracije H iona3O+ i oh- različiti, proizvod između njih ostat će konstantan.
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Jonski proizvod vode (Kw)"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm. Pristupljeno 28. lipnja 2021.



