THEosmoza i prolaz otapala, iz manje koncentrirane otopine u koncentriraniju otopinu, kroz polupropusna membrana, sve dok pritisak koji otopina vrši na membranu spriječi prolazak otapala. Namijenjen je ovom procesu uravnotežiti koncentraciju otopine.
Pročitajte i vi: Otopljena tvar i otapalo
Osmotski tlak
THE Osmotski tlak i pritisak koji se vrši na otopinu s većom koncentracijom tako da se osmoza ne dogodi, odnosno da otapalo ne prijeđe polupropusnu membranu.
Osmotski tlak koristi se u procesima desalinizacija vode, forsirajući proces obrnuta osmoza, što dovodi do prelaska otapala iz koncentrirane otopine u manje koncentriranu. Taj proces nazivamo obrnuta osmoza. Pogledajte sljedeću sliku koja uspoređuje dva procesa:
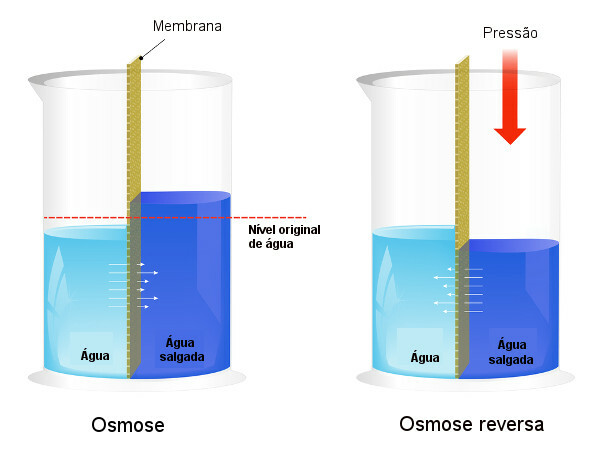
Imajte na umu da je u osmozi prolazak otapala u smjeru najkoncentriranije otopine i da je u obrnutoj osmozi prolazak u suprotnom smjeru, zbog primijenjenog tlaka. Da biste saznali više o temi, pročitajte naš tekst: Osmotski tlak.
znati više: Obrnuta osmoza u desalinizaciji morske vode
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
jednadžba osmotskog tlaka
Osmotski pritisak, predstavljen slovom pi (π) rješenja, može se izračunati sljedećom jednadžbom:
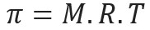
M = koncentracija u mol / L
R = univerzalna konstanta savršenih plinova
T = apsolutna temperatura, u K
poput ostalih koligativna svojstva, osmotski tlak ovisi o koncentracija otopine, to jest što je veća koncentracija otopine, to je veći učinak osmoze na otopine i, prema tome, veći je osmotski tlak.
Primjeri
Osmoza se pojavljuje u našem svakodnevnom životu u različito vrijeme. Možemo navesti primjer postupak soljenja mesa vašem konzervacija. Vas mikroorganizmi to bi prouzročilo degradaciju mesa izgubiti voduiznutra prema van, koji ima koncentraciju soli, što čini da hrana duže traje.
Zbog soli se također događa da listovi salate uvenu za gubljenje vode iz njihove unutrašnjosti Stanice (vrsta manje koncentrirane) za kaljeno rješenje u vanjskom okruženju.
Osmoza je također važna kada govorimo o tome krv ljudski. Kažemo da je Crvene stanice a krv je jedna izotonični medij, odnosno imaju jednak osmotski tlak, što omogućuje lak ulaz i izlaz vode iz stanice.
Međutim, kada krv postane manje koncentrirana nego unutar crvenih krvnih stanica (hipotonični medij), prolazak vode će se lakše dogoditi unutar stanice, čineći je nabubri do pucanja. Ako krv postigne koncentraciju veću od koncentracije crvenih stanica (hipertonični medij), krvne stanice uvenu, jer gube vodu.

Po istom principu konzerviranja mesa, očuvanje voćau kompotima od slatkiša, koji hranu čuvaju zbog visoka koncentracija šećera u otopini.
Slijede drugi primjeri gdje se javlja osmoza:
- u porastu soka u vodljivim posudama biljke;
- u hemodijaliza;
- u selektivnom prolasku hranjivih sastojaka u stanice ljudskog tijela.
Da biste razumjeli kako se osmoza događa u životinjskoj stanici, biljnoj stanici i drugim biološkim problemima, pročitajte: Osmoza: što je to i kako se javlja u životinjskoj i biljnoj stanici.
Napisao Victor Ferreira
Učitelj kemije
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FERREIRA, Victor Ricardo. "Osmoza"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/osmose.htm. Pristupljeno 28. lipnja 2021.



