Reakcije redukcije oksidacije koje se javljaju u prisutnosti vodikovog peroksida (vodena otopina vodikovog peroksida - H2O2 (vod.)) predstavljaju poseban slučaj koji se mora analizirati odvojeno, uglavnom s obzirom na njegovu ravnotežu. To je zato što kisici u vodikovom peroksidu, koji imaju Nox jednak -1, mogu ili oksidirati ili reducirati.
Na primjer, pogledajmo dva slučaja u kojima se ponaša prvo kao oksidirajuće sredstvo (reducirajući), a zatim kao reducirajuće sredstvo (oksidacijsko):
- oksidirajuće sredstvo: kad god se vodikov peroksid reducira, djelujući kao oksidirajuće sredstvo, on stvara vodu kao proizvod.
Ako otopini koja sadrži jodidne ione dodamo otopinu vodikovog peroksida (I-) u kiselom mediju imat ćemo:
H2O2 (vod.) + Ja-(ovdje) + H+(ovdje) → H2O(1) + Ja2
Pazite da nastaju voda i jod. Ali da biste provjerili je li vodikov peroksid doista djelovao kao oksidacijsko sredstvo i reducirao se, promatrajte određivanje oksidacijskih brojeva (NOx): *

Kisik Nox vodikovog peroksida smanjio se s -1 na -2, s obzirom da je primio 1 elektron. Međutim, kako imamo po dva kisika u svakoj molekuli vodikovog peroksida (H
2O2), varijacija Nox bit će jednaka 2.Dakle, kao što je prikazano u tekstu “Redox balansiranje”, Neophodan korak za uravnoteženje reakcija metodom oksidacijsko-redukcijske reakcije jest inverzija vrijednosti varijacija Nox-a koeficijentima, koji su, u ovom slučaju, kako slijedi:
* H2O2 = 2 (oxNox) = 2 → 2 bit će koeficijent I-;
* Ja-= ∆Nox = 1 → 1 bit će koeficijent H2O2.
Dakle, imamo:
1 sat2O2 (vod.) + 2 I-(ovdje) + H+(ovdje) → H2O(1) + Ja2
Postizanje ostalih koeficijenata uravnoteženjem pokusima:
- Budući da se u prvom članu nalaze dva atoma kisika, koeficijent vode u drugom članu mora biti jednak 2. A budući da se u prvom članu nalaze i dva jodidna iona, koeficijent joda u drugom članu bit će 1. Ne zaboravite da indeks moramo pomnožiti s koeficijentom da bismo pronašli ispravnu količinu atoma i iona u svakom članu:
1 sat2O2 (vod.) + 2 I-(ovdje) + H+(ovdje) → 2 h2O(1) + 1 I2
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
- Sada ostaje samo uravnotežiti kation vodika 1. člana, a njegov će koeficijent morati biti jednak 2, jer u 2. članu ima 4 vodika, a u 1. članu već ima dva:
1 sat2O2 (vod.) + 2 I-(ovdje) +2 H+(ovdje) → 2 h2O(1) + 1 I2
- redukcijsko sredstvo: kad god vodikov peroksid oksidira, djelujući kao redukcijsko sredstvo, stvara kisik (O2) kao proizvod.
Primjer redukcije vodikovog peroksida je kada dolazi u kontakt s kalijevim permanganatom (KMnO4). Ova tvar ima vrlo karakterističnu ljubičastu boju, ali kada dođe u kontakt s vodikovim peroksidom postaje bezbojna. To je zato što je sav mangan prisutan u ionu MnO4- otopine permanganata se reducira, dajući ionu Mn2+, kako je prikazano dolje:
+1 -1 +7 -2 +1 0 +2 +1 -2
H2O2 + MnO4-+ H+ → The2 + Mn2++ H2O
Izračunavajući Nox, vidimo da kisik u vodikovom peroksidu zapravo oksidira i uzrokuje smanjenje mangana:
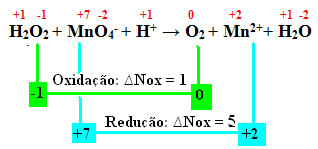
Kao i u prethodnom primjeru, ∆Noks vodikovog peroksida bit će jednak 2, budući da postoje dva kisika i svaki gubi elektron. Stoga imamo:
* O2 = 2 (oxNox) = 2 → 2 bit će koeficijent MnO4-;
* MnO4- = ∆Nox = 5 → 5 bit će koeficijent O2.
I kao i svi O2 potječe od vodikovog peroksida, dvije supstance imaju isti koeficijent:
5 H2O2 + 2MnO4-+ H+ → 5 O2 + Mn2++ H2O
Balansirajući pokusnom metodom, imamo:
5 sati2O2 + 2 MnO4-+ 6 H+ → 5 O2 + 2 milijuna2++ 8 H2O
* Za sva pitanja o tome kako izračunati oksidacijski broj (Nox) atoma i iona u reakciji, pročitajte tekst "Određivanje oksidacijskog broja (Nox)".
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Reakcije redukcije oksidacije koje uključuju vodikov peroksid"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-envolvendo-agua-oxigenada.htm. Pristupljeno 28. lipnja 2021.