THE hidroliza soli između jakih kiselina i baza javlja se kada kation u soli ne stupa u interakciju s anionom u vodi, a anion u soli ne djeluje s kationom u vodi. Hidroliza između kationa i aniona soli i vode događa se samo kada je nastali proizvod slaba kiselina, slaba baza ili oboje. Korak po korak shvatite hidrolizu soli između jakih kiselina i jakih baza:
a) Korak 1: jonizacija vode
Voda je tvar koja ima sposobnost patnje autoionizacija, odnosno proizvodi hidronijev kation (H+) i hidroksid anion (OH-) iz njegove strukture.
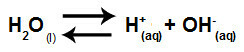
Jednadžba koja predstavlja samoionizaciju vode
b) Korak 2: Disocijacija soli
Kad se sol doda vodi, ona prolazi kroz proces disocijacije. Kako je sol ionski spoj, u vodi se njezini kationi i anioni oslobađaju u medij, kao u donjoj jednadžbi:
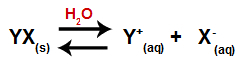
Jednadžba koja predstavlja disocijaciju bilo koje soli
c) Korak 3: Hidroliza soli jakih kiselina i baza
Za jaku kiselinu: kada se anion soli kombinira s H+ vode da nastane HCl, HBr, HI ili druga kiselina u kojoj je oduzimanje broja kisika s brojem vodika jednako ili veće od 2, imat ćemo
jaka kiselina. Stoga se kombinacija između spomenutih iona ne događa.Za snažne temelje: kada se kation soli koja pripada obitelji IA (alkalni metali) ili IIA (zemnoalkalni metali, osim magnezija) kombinira s OH- vode, stvorit će a snažni temelj. Stoga se kombinacija između spomenutih iona ne događa.
Kada joni soli ne stupaju u interakciju s vodenim ionima, imamo sljedeću jednadžbu:
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
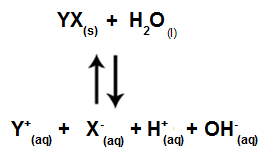
Jednadžba koja pokazuje sve ione prisutne u otopini
Ukratko, kako solni ioni ne stupaju u interakciju s vodenim ionima, solni ioni ne potiču nikakve promjene u konačnoj otopini. Dakle, jednadžbu hidrolize soli između jakih kiselina i jakih baza možemo napisati jednadžbom jonizacije vode.
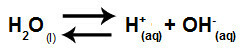
Jednadžba koja predstavlja hidrolizu jakih kiselina i baza
d) Primjer hidrolize soli između jakih kiselina i baza
Kad u vodu dodamo sol kalijevog klorata (KClO3), sol se disocira i oslobađa kalij-kation (K+) i klorat anion (ClO3-) u sredini.
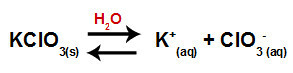
Jednadžba disocijacije za kalijev klorat
Važno je zapamtiti da voda prolazi kroz samoionizaciju i daje mediju kation hidronija (H+) i hidroksid anion (OH-). Sada moramo procijeniti interakciju između soli i vodenih iona.
Kad je H+ stupa u interakciju s ClO3-, tvori perklornu kiselinu (HclO3). Budući da je oduzimanje broja kisika od broja ionizirajućih vodika u perklornoj kiselini 2, to je jako. Stoga se interakcija između iona ne događa.
Kad je K kation+ stupa u interakciju s OH anionom-, imamo stvaranje jake baze, jer je kalij alkalni metal. Stoga se interakcija između iona ne događa.
Jednadžba koja predstavlja hidrolizu soli između jakih kiselina i baza iz otapanja kalijevog klorata u vodi je:
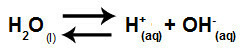
Kemijska jednadžba hidrolize kalijevog klorata
Ja, Diogo Lopes Dias
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
DANI, Diogo Lopes. "Hidroliza slane otopine između jakih kiselina i jakih baza"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm. Pristupljeno 28. lipnja 2021.
Kemija

Provjerite svoje znanje i naučite više pomoću ovog popisa riješenih vježbi na kemijskim vagama. Kroz ovaj materijal moći ćete bolje razumjeti kako raditi konstante ravnoteže (Kp, Kc i Ki), pomak ravnoteže, pH i pOH, kao i ravnotežu u takozvanim puferskim otopinama.


