एक रासायनिक प्रतिक्रिया होने के लिए चार बुनियादी शर्तों को पूरा करना आवश्यक है, जो हैं:
1. अभिकर्मकों से संपर्क करना चाहिए;
2. अभिकर्मकों के बीच रासायनिक आत्मीयता होनी चाहिए;
3. अभिकर्मक कणों के बीच टकराव प्रभावी होना चाहिए;
4. सक्रियण ऊर्जा तक पहुंचना चाहिए।
प्रत्येक मामले को संक्षेप में देखें:
1.अभिकर्मकों के बीच संपर्क:
यह स्थिति स्पष्ट है, क्योंकि भले ही अभिकारकों में एक दूसरे के साथ बहुत अधिक आत्मीयता हो, जैसे कि अम्ल और क्षार के मामले में, यदि वे अलग हो जाते हैं, तो प्रतिक्रिया नहीं होगी। उन्हें संपर्क में आने की आवश्यकता है ताकि उनके कण टकरा सकें, अभिकारकों के बंधनों को तोड़कर उत्पादों के बंधन बना सकें।

2.रासायनिक आत्मीयता:
जैसा कि हमने देखा, अभिकर्मकों को संपर्क में लाना आवश्यक है, लेकिन पर्याप्त नहीं है। उदाहरण के लिए, यदि हम सोडियम को पानी के संपर्क में रखते हैं, तो अत्यधिक हिंसक प्रतिक्रिया होगी, लेकिन यदि हम सोना डालते हैं, तो हमें कोई अंतर नहीं दिखाई देगा। ऐसा इसलिए है क्योंकि अलग-अलग पदार्थों में एक-दूसरे के साथ अलग-अलग रासायनिक समानताएं होती हैं, या उनमें कोई समानता नहीं हो सकती है। रासायनिक आत्मीयता जितनी अधिक होगी, प्रतिक्रिया उतनी ही तेज होगी।
उल्लिखित उदाहरणों में, सोडियम का पानी के साथ इतना अधिक संबंध है कि हवा में नमी के संपर्क में न आने के लिए, धातु सोडियम मिट्टी के तेल में जमा हो जाता है। सोना निष्क्रिय है, यही वजह है कि सोने के स्मारक इतने लंबे समय तक चलते हैं, जैसे मिस्र के सरकोफेगी।

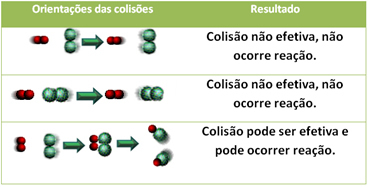
3.टक्कर सिद्धांत:
रासायनिक समानता वाले यौगिकों में भी, प्रतिक्रिया को आगे बढ़ने के लिए यह आवश्यक है कि उनके कण, परमाणु या अणु प्रभावी ढंग से टकराएं। टकराने वाले सभी कण इसे प्रभावी ढंग से नहीं करते हैं, लेकिन झटके के परिणामस्वरूप टूट जाते हैं अभिकर्मक बंध और नए बंधों का निर्माण वे होते हैं जो सही अभिविन्यास में और ऊर्जा के साथ होते हैं पर्याप्त।
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
नीचे दो अप्रभावी टक्करों और एक प्रभावी टक्कर का मामला दिखाया गया है जिसके परिणामस्वरूप प्रतिक्रिया होती है।
4.सक्रियण ऊर्जा और सक्रिय परिसर:
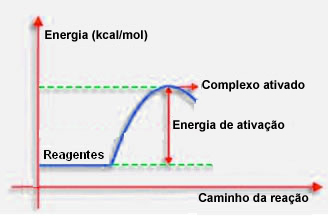
जैसा कि पिछले मद में कहा गया है, प्रभावी टक्कर, अनुकूल मार्गदर्शन के अलावा, पर्याप्त ऊर्जा की भी आवश्यकता होती है। प्रत्येक प्रतिक्रिया के लिए आवश्यक ऊर्जा की न्यूनतम मात्रा सक्रियण ऊर्जा कहलाती है।
यदि अभिकारकों की ऊर्जा वेल-ओरिएंटेड शॉक के दौरान सक्रियण ऊर्जा के बराबर या उससे अधिक होती है, एक प्रारंभिक रूप से सक्रिय परिसर बनेगा, जो अभिकारकों और के बीच एक मध्यवर्ती संरचना है उत्पाद। सक्रिय परिसर में, कमजोर अभिकर्मक बंधन और नए उत्पाद बंधन बनते हैं।
इस प्रकार, सक्रियण ऊर्जा प्रतिक्रिया के होने के लिए एक तरह के अवरोध के रूप में काम करती है, क्योंकि यह जितना बड़ा होगा, प्रतिक्रिया के लिए उतना ही कठिन होगा। कुछ मामलों में, अभिकर्मकों को ऊर्जा की आपूर्ति करना आवश्यक है। उदाहरण के लिए, रसोई गैस में हवा में ऑक्सीजन के साथ बातचीत करने के लिए एक समानता है, लेकिन जब हम मैच को एक साथ लाते हैं तो हमें ऊर्जा की आपूर्ति करने की आवश्यकता होती है, अन्यथा प्रतिक्रिया नहीं होती है। लेकिन एक बार शुरू होने के बाद, प्रतिक्रिया स्वयं अन्य अणुओं को सक्रिय करने और प्रतिक्रिया को चालू रखने के लिए पर्याप्त ऊर्जा छोड़ती है।
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
FOGAÇA, जेनिफर रोचा वर्गास। "रासायनिक प्रतिक्रियाओं की घटना के लिए शर्तें"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm. 27 जून, 2021 को एक्सेस किया गया।



