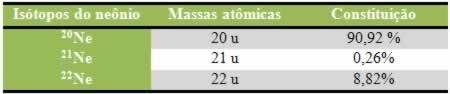
विलेय और विलायक एक समांगी मिश्रण के दो घटक हैं जिन्हें रासायनिक विलयन कहा जाता है।
- घुला हुआ पदार्थ: वह पदार्थ है जो विलायक में छितराया जाता है। यह उस पदार्थ से मेल खाता है जो भंग हो जाएगा और, आम तौर पर, समाधान में खुद को थोड़ी मात्रा में प्रस्तुत करता है।
- विलायक: वह पदार्थ है जिसमें एक नया उत्पाद बनाने के लिए विलेय को भंग किया जाएगा। यह स्वयं को विलयन में अधिक मात्रा में प्रस्तुत करता है।
विलेय (छितरी हुई) और विलायक (फैलाने वाली) के बीच विघटन उनके अणुओं के बीच बातचीत के माध्यम से होता है।
घोल के इन दो घटकों के बीच का अंतर यह है कि विलेय वह पदार्थ है जो घुल जाएगा और विलायक वह पदार्थ है जो विघटन को प्रभावित करेगा।
सबसे अच्छा ज्ञात विलायक पानी है, जिसे माना जाता है सार्वभौमिक विलायक. ऐसा इसलिए क्योंकि इसमें बड़ी मात्रा में पदार्थों को घोलने की क्षमता होती है।
विलायक और विलायक उदाहरण
रासायनिक समाधानों के कुछ उदाहरण देखें और उनमें से प्रत्येक के विलेय और विलायकों की खोज करें:
पानी और नमक
- विलेय: टेबल नमक - सोडियम क्लोराइड (NaCl)
- विलायक: जल
चूंकि यह एक आयनिक यौगिक है, समाधान में सोडियम क्लोराइड अलग हो जाता है और आयन बनाता है, जो बदले में, अणुओं द्वारा घुल जाता है पानी.
पानी का धनात्मक ध्रुव (H .)+) नमक के आयन (Cl .) के साथ परस्पर क्रिया करता है-) और पानी का ऋणात्मक ध्रुव (O .)2-) धनायन के साथ परस्पर क्रिया करता है (Na+).
यह एक प्रकार का इलेक्ट्रोलाइटिक समाधान है, क्योंकि समाधान में आयनिक प्रजातियां विद्युत प्रवाह का संचालन करने में सक्षम हैं।
पानी और चीनी
- विलेय: चीनी - सुक्रोज (C .)12एच22हे11)
- विलायक: जल

चीनी एक सहसंयोजक यौगिक है और पानी में घुलने पर अणुओं वे तितर-बितर हो जाते हैं लेकिन अपनी पहचान नहीं बदलते।
इस जलीय घोल को गैर-इलेक्ट्रोलाइटिक के रूप में वर्गीकृत किया जाता है, क्योंकि घोल में फैला हुआ विलेय तटस्थ होता है और इसलिए पानी के साथ प्रतिक्रिया नहीं करता है।
सिरका
- विलेय: एसिटिक अम्ल (CH .)3सीओओएच)
- विलायक: जल

सिरका एक ऐसा घोल है जिसमें कम से कम 4% एसिटिक एसिड होता है, a कार्बोज़ाइलिक तेजाब जो ध्रुवीय होने के कारण हाइड्रोजन बंधों के माध्यम से जल के साथ-साथ ध्रुवीय भी परस्पर क्रिया करता है।
घुलनशीलता के लिए एक महत्वपूर्ण नियम यह है कि जैसे घुलता है वैसे ही घुलता है। ध्रुवीय यौगिक ध्रुवीय सॉल्वैंट्स में घुल जाते हैं, जबकि गैर-ध्रुवीय पदार्थ गैर-ध्रुवीय सॉल्वैंट्स में घुल जाते हैं।
अन्य समाधान
तरल समाधानों के अलावा, गैसीय और ठोस समाधान भी होते हैं।
हम जिस हवा में सांस लेते हैं वह एक गैसीय घोल का उदाहरण है, जिसकी गैसें अधिक मात्रा में नाइट्रोजन (78%) और ऑक्सीजन (21%) हैं।
पर मिश्र धातु वे ठोस समाधान हैं। उदाहरण के लिए, पीतल (जस्ता और तांबा) संगीत वाद्ययंत्र बनाने के लिए इस्तेमाल किया जाने वाला मिश्रण है।
अधिक ज्ञान प्राप्त करना चाहते हैं? तो इन अन्य ग्रंथों को पढ़ें:
- रासायनिक समाधान
- अंतर आणविक बल
- सजातीय और विषमांगी मिश्रण
घुलनशीलता गुणांक क्या है?
घुलनशीलता गुणांक किसी दिए गए तापमान पर एक संतृप्त घोल बनाने के लिए विलायक में जोड़े गए विलेय की सीमा है।
हे घुलनशीलता गुणांक परिस्थितियों के अनुसार बदलता रहता है, और तापमान में परिवर्तन और प्रश्न में विलेय के अनुसार बढ़ या घट सकता है।
एक सीमा है जिसके लिए विलायक विघटन कर सकता है।
उदाहरण: अगर आप एक गिलास पानी में चीनी डालेंगे तो सबसे पहले आप देखेंगे कि चीनी पानी में गायब हो गई है।
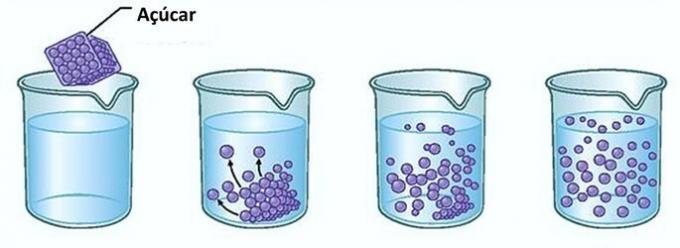
हालांकि, यदि आप चीनी डालना जारी रखते हैं, तो आप पाएंगे कि किसी बिंदु पर यह गिलास के तल में जमा होना शुरू हो जाएगा।
ऐसा इसलिए है क्योंकि पानी, जो कि विलायक है, अपनी सीमा तक पहुंच गया है घुलनशीलता और एकाग्रता की अधिकतम मात्रा। वह विलेय जो पात्र के तल पर रहता है और घुलता नहीं है, कहलाता है पृष्ठभूमि शरीर.
कांच के तल में अतिरिक्त चीनी नहीं घुलेगी और न ही घोल की सांद्रता को प्रभावित करेगी। इसके अलावा, गिलास के तल में जमा चीनी पानी को मीठा नहीं बनायेगी।
समाधानों का वर्गीकरण
विलयनों को घुलित विलेय की मात्रा के आधार पर वर्गीकृत किया जा सकता है। इस प्रकार, वे तीन प्रकार के हो सकते हैं: संतृप्त, असंतृप्त और अतिसंतृप्त।
- संतृप्त घोल: विलयन विलेयता गुणांक की सीमा तक पहुंच गया है, अर्थात एक निश्चित तापमान पर विलायक में घुले हुए विलेय की अधिकतम मात्रा होती है।
- असंतृप्त विलयन: घुले हुए विलेय की मात्रा अभी तक विलेयता गुणांक तक नहीं पहुंची है। इसका मतलब है कि अधिक विलेय जोड़ा जा सकता है।
- अतिसंतृप्त विलयन: सामान्य परिस्थितियों की तुलना में अधिक घुलित विलेय होता है। इस मामले में, वे एक अवक्षेप प्रस्तुत करते हैं।
समाधान के बारे में अधिक जानने के लिए, निम्नलिखित पाठ पढ़ें।:
- समाधान का कमजोर पड़ना
- मोललिटी
- मोलरिटी
- टाइट्रेट करना
समाधान की एकाग्रता
विलेय और विलायक से किसी विलयन की सांद्रता की गणना करना संभव है।
सामान्य सांद्रता को घोल के दिए गए आयतन में घुले हुए विलेय के द्रव्यमान के अनुपात के रूप में परिभाषित किया जाता है।
एकाग्रता की गणना निम्न सूत्र का उपयोग करके की जाती है:
होना,
सी: एकाग्रता (जी/एल);
म: विलेय का द्रव्यमान (g);
वी: समाधान मात्रा (एल)।
उदाहरण:
(Faap) 400 एमएल घोल में 30 ग्राम नमक युक्त सोडियम नाइट्रेट के जलीय घोल की सांद्रता, g/L में परिकलित करें:
संकल्प:
विलेय और विलायक की मात्रा के संबंध में जानकारी का निरीक्षण करें। 400 एमएल जलीय घोल (विलायक) में 30 ग्राम नमक (विलेय) होता है।
हालाँकि, आयतन mL में है और हमें इसे L में बदलने की आवश्यकता है:
अब, एकाग्रता जानने के लिए, आपको बस सूत्र लागू करना होगा:
इस परिणाम के साथ, हम इस निष्कर्ष पर पहुंचे कि जब हम ३० ग्राम नमक को ४०० मिलीलीटर पानी में मिलाते हैं, तो हमें ७५ ग्राम/लीटर की सांद्रता वाला घोल प्राप्त होता है।
सामान्य एकाग्रता की गणना कैसे करें, इस बारे में अधिक जानकारी के लिए, ये पाठ सहायक होंगे।:
- समाधान एकाग्रता
- सामान्य एकाग्रता पर व्यायाम