रसायन विज्ञान सीखने वाले किसी भी व्यक्ति के लिए सबसे बड़ी चुनौतियों में से एक इलेक्ट्रॉनिक वितरण है। इस संदर्भ में हम जो प्रस्तुत करने जा रहे हैं, वह वैज्ञानिक लिनुस पॉलिंग द्वारा प्रस्तावित इलेक्ट्रॉन विन्यास से संबंधित आपके अध्ययन को बहुत सुविधाजनक बना सकता है।
प्रत्येक परत या ऊर्जा स्तर में फिट होने वाले इलेक्ट्रॉनों की अधिकतम संख्या तालिका के माध्यम से दी गई है:
ऊर्जा स्तर परत इलेक्ट्रॉनों की अधिकतम संख्या
पहला कश्मीर 2
दूसरा एल 8
तीसरा एम 18
चौथा एन 32
5° हे 32
छठा पी १८
७वाँ क्यू ८
उप-स्तरों की ऊर्जा का बढ़ता क्रम विकर्णों के क्रम में क्रम है। लिनुस पॉलिंग आरेख नीचे दिखाया गया है:
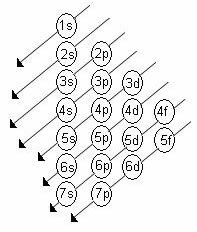
बुनियादी नियम:
1. तत्व की परमाणु संख्या (Z), तटस्थ अवस्था में, वितरित होने वाले इलेक्ट्रॉनों की संख्या को इंगित करती है। यह संख्या तत्व प्रतीक के निचले बाएँ भाग में प्रदर्शित होती है।
2. पॉलिंग आरेख का उपयोग करके, ऊर्जा के बढ़ते क्रम (तीरों की दिशा द्वारा उन्मुख) को ध्यान में रखते हुए, ऊपर से नीचे तक इलेक्ट्रॉनों को वितरित करना शुरू करें।
3. उपस्तरों को इलेक्ट्रॉनों के अधिकतम स्तर से भरें। यदि किसी दिए गए सबलेवल में केवल 6 इलेक्ट्रॉन होते हैं, तो उस राशि से अधिक न करें।
4. प्रत्येक सबलेवल में उन्हें जोड़कर इलेक्ट्रॉनों की संख्या की जाँच करें।
आइए इसे व्यवहार में लाएं?
लोहे के परमाणु के इलेक्ट्रॉनों को वितरित करें (Z=26)।
यदि परमाणु क्रमांक 26 है, तो इसका अर्थ है कि सामान्य लौह परमाणु में 26 इलेक्ट्रॉन होते हैं। पॉलिंग आरेख को लागू करने पर, हमारे पास होगा:

लिरिया अल्वेस द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm
