प्रयोगशालाओं और रासायनिक उद्योगों में प्रतिक्रियाओं में शामिल पदार्थों की मात्रा जानना बहुत महत्वपूर्ण है। इसलिए, नीचे हम परमाणुओं के द्रव्यमान से संबंधित मुख्य अवधारणाओं, मात्राओं और माप इकाइयों से निपटेंगे:
- परमाणु द्रव्यमान इकाई (यू):
परमाणु द्रव्यमान इकाई को निर्दिष्ट करने के लिए मानक वजन संदर्भ परमाणु कार्बन -12 है (12सी)। एक परमाणु द्रव्यमान इकाई (1 u) 1.66054 के मान से मेल खाती है। 10-24 जी, जो कार्बन समस्थानिक के 1/12 का द्रव्यमान है जिसका द्रव्यमान 12 के बराबर है (12सी)।
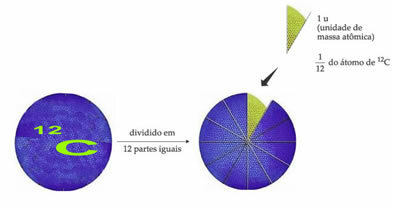
परमाणु द्रव्यमान इकाई (यू) नीचे सूचीबद्ध सभी मात्राओं में उपयोग की जाने वाली इकाई है।
- एक परमाणु या समस्थानिक (एमए) का परमाणु द्रव्यमान:
इसे पिछले मद में उल्लिखित संदर्भ मूल्य के साथ तुलना करके प्राप्त किया जाता है। उदाहरण के लिए, का परमाणु द्रव्यमान 919F मास स्पेक्ट्रोमीटर द्वारा दिया जाता है, जो 18.9984 u के बराबर होता है। गोल करने पर, यह 19 के बराबर होता है, जो इसकी द्रव्यमान संख्या (A) के समान मान है। इस मान का अर्थ है कि तत्व का परमाणु द्रव्यमान 919F, 1/12 के द्रव्यमान से 19 गुना अधिक है 12सी।
- एक तत्व का परमाणु द्रव्यमान (AM):
तत्व का परमाणु द्रव्यमान उसके समस्थानिकों के परमाणु द्रव्यमान के भारित औसत से निर्धारित होता है। यह प्रत्येक आइसोटोप के परमाणु द्रव्यमान को तत्व के संविधान में प्रकट होने वाले प्रतिशत से गुणा करके किया जाता है। फिर इन मूल्यों को जोड़ा जाता है, जो 100 से विभाजित होते हैं, जिसके परिणामस्वरूप कुल प्रतिशत होता है।
उदाहरण के लिए, तत्व नियॉन तीन समस्थानिकों से बना होता है, जिसमें निम्नलिखित परमाणु द्रव्यमान और उनके संविधान में प्रतिशत होते हैं:

इस तत्व के परमाणु द्रव्यमान (एमए) की गणना:
खराबनीयन = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
खराबनीयन = 20,179 यू
- आणविक द्रव्यमान (एमएम):
जैसा कि नाम से ही स्पष्ट है, इसका उपयोग आणविक पदार्थों के लिए किया जाता है, अर्थात परमाणुओं को इलेक्ट्रॉनों के जोड़े के साझाकरण के माध्यम से जोड़ा जाता है, जिन्हें सहसंयोजक बंधन कहा जाता है।
आणविक द्रव्यमान प्रत्येक तत्व के परमाणुओं की संख्या को उनके परमाणु द्रव्यमान से गुणा करके और परिणामों को जोड़कर प्राप्त किया जाता है।
उदाहरण के लिए, CO अणु2 इसमें एक कार्बन और दो ऑक्सीजन होते हैं, इसलिए हम कार्बन के परमाणु द्रव्यमान को 1 से गुणा करेंगे; और दो से ऑक्सीजन, बाद में उन्हें जोड़ना:
मिमीसीओ 2 = (1. खराबसी) + (2. खराबहे)
मिमीसीओ 2 = (1. 12) + (2. 16)
मिमीसीओ 2 = 12 + 32
मिमीसीओ 2 = ४४ यू
- मास-सूत्र:
यह वही गणना है जो आणविक द्रव्यमान के लिए की जाती है, हालांकि, आयनिक यौगिकों के लिए। इस मामले में नाम अलग है, क्योंकि उन्हें अणुओं में नहीं, बल्कि आयनों के समूहों में बांटा गया है। चूंकि अणु मौजूद नहीं हैं, आणविक द्रव्यमान के बारे में बात करने का कोई मतलब नहीं है, लेकिन गणना के पीछे तर्क एक ही है।
उदाहरण:
सोडियम क्लोराइड
↓ ↓
२३ +३५.५ → सूत्र द्रव्यमान = ५८.५ u
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm
