हाइड्रोजन पेरोक्साइड (हाइड्रोजन पेरोक्साइड का जलीय घोल - H .) की उपस्थिति में होने वाली ऑक्सीकरण-कमी प्रतिक्रियाएं2हे2(एक्यू)) एक विशेष मामला बनता है जिसका अलग से विश्लेषण किया जाना चाहिए, मुख्य रूप से इसके संतुलन के संबंध में। ऐसा इसलिए है क्योंकि हाइड्रोजन पेरोक्साइड में ऑक्सीजन, जिसमें नॉक्स -1 के बराबर होता है, या तो ऑक्सीकरण कर सकता है या कम कर सकता है।
उदाहरण के लिए, आइए दो मामलों को देखें जिसमें यह पहले ऑक्सीकरण एजेंट (कम करने) के रूप में और फिर कम करने वाले एजेंट (ऑक्सीकरण) के रूप में व्यवहार करता है:
- ऑक्सीकरण एजेंट: जब भी हाइड्रोजन परॉक्साइड को कम किया जाता है, ऑक्सीकरण एजेंट के रूप में कार्य करता है, तो यह उत्पाद के रूप में पानी उत्पन्न करता है।
यदि हम आयोडाइड आयनों वाले विलयन में हाइड्रोजन परॉक्साइड का विलयन मिलाते हैं (I .)-) एक अम्लीय माध्यम में, हमारे पास होगा:
एच2हे2(एक्यू) + मैं-(यहां) +एच+(यहां) → एच2हे(1) + मैं2(रों)
देखें कि पानी और आयोडीन बनता है। लेकिन यह जांचने के लिए कि क्या हाइड्रोजन पेरोक्साइड वास्तव में एक ऑक्सीकरण एजेंट के रूप में काम करता है और कम हो जाता है, ऑक्सीकरण संख्या (NOx) के निर्धारण का निरीक्षण करें:*

हाइड्रोजन पेरोक्साइड का ऑक्सीजन नॉक्स -1 से घटकर -2 हो गया, यह देखते हुए कि इसे 1 इलेक्ट्रॉन प्राप्त हुआ। हालाँकि, चूंकि हमारे पास प्रत्येक हाइड्रोजन पेरोक्साइड अणु (H .) में दो ऑक्सीजन होते हैं2हे2), Nox भिन्नता 2 के बराबर होगी।
तो, जैसा कि पाठ में दिखाया गया है "रेडॉक्स संतुलन”, ऑक्सीकरण-कमी विधि द्वारा प्रतिक्रियाओं को संतुलित करने के लिए एक आवश्यक कदम गुणांक द्वारा नॉक्स की विविधताओं के मूल्यों को उलटा करना है, इस मामले में, निम्नानुसार है:
* हो2हे2 = 2 (∆Nox) = 2 → 2 I. का गुणांक होगा-;
* मैं-= ∆Nox = 1 → 1 H. का गुणांक होगा2हे2.
इस प्रकार, हमारे पास है:
1 घंटा2हे2(एक्यू) + 2 मैं-(यहां) + एच+(यहां) → एच2हे(1) + मैं2(रों)
परीक्षणों द्वारा संतुलन बनाकर अन्य गुणांकों को मारना:
- चूँकि पहले सदस्य में दो ऑक्सीजन परमाणु होते हैं, दूसरे सदस्य में पानी का गुणांक 2 के बराबर होना चाहिए। और चूँकि पहले सदस्य में भी दो आयोडाइड आयन होते हैं, दूसरे सदस्य में आयोडीन गुणांक 1 होगा। यह मत भूलो कि हमें प्रत्येक सदस्य में परमाणुओं और आयनों की सही मात्रा खोजने के लिए सूचकांक को गुणांक से गुणा करना होगा:
1 घंटा2हे2(एक्यू) + 2 मैं-(यहां) +एच+(यहां) → 2 एच2हे(1) + 1 मैं2(रों)
- अब यह केवल 1 सदस्य के हाइड्रोजन केशन को संतुलित करने के लिए रहता है, और इसका गुणांक 2 के बराबर होना चाहिए, क्योंकि दूसरे सदस्य में इसमें 4 हाइड्रोजेन होते हैं और पहले सदस्य में पहले से ही दो होते हैं:
1 घंटा2हे2(एक्यू) + 2 मैं-(यहां) +2 एच+(यहां) → 2 एच2हे(1) + 1 मैं2(रों)
- अपचायक कारक: जब भी हाइड्रोजन पेरोक्साइड ऑक्सीकरण करता है, एक कम करने वाले एजेंट के रूप में कार्य करता है, तो यह ऑक्सीजन उत्पन्न करता है (O .)2) एक उत्पाद के रूप में।
एक उदाहरण जहां हाइड्रोजन पेरोक्साइड कम हो रहा है, जब यह पोटेशियम परमैंगनेट (KMnO .) के संपर्क में आता है4). इस पदार्थ में एक बहुत ही विशिष्ट बैंगनी रंग होता है, लेकिन जब यह हाइड्रोजन पेरोक्साइड के संपर्क में आता है तो यह रंगहीन हो जाता है। ऐसा इसलिए है क्योंकि MnO आयन में मौजूद सभी मैंगनीज4- परमैंगनेट का विलयन कम हो जाता है, जिससे Mn आयन बनता है2+, जैसा कि नीचे दिया गया है:
+1 -1 +7 -2 +1 0 +2 +1 -2
एच2हे2 + एमएनओ4-+ एच+ → The2 + एमएन2++ एच2हे
नॉक्स की गणना करते हुए, हम देखते हैं कि हाइड्रोजन पेरोक्साइड में ऑक्सीजन वास्तव में ऑक्सीकरण करता है और मैंगनीज की कमी का कारण बनता है:
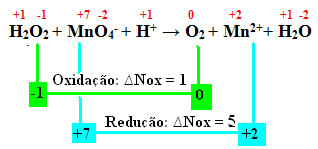
पिछले उदाहरण की तरह, हाइड्रोजन पेरोक्साइड का Nox 2 के बराबर होगा, क्योंकि दो ऑक्सीजन हैं और प्रत्येक एक इलेक्ट्रॉन खो देता है। इसलिए, हमारे पास है:
* ओ2 = 2 (∆Nox) = 2 → 2 MnO. का गुणांक होगा4-;
*एमएनओ4- = नॉक्स = 5 → 5 O. का गुणांक होगा2.
और सभी की तरह ओ2 हाइड्रोजन पेरोक्साइड से आता है, दो पदार्थों का गुणांक समान होता है:
5 एच2हे2 + 2एमएनओ4-+ एच+ → 5 हे2 + एमएन2++ एच2हे
परीक्षण विधि द्वारा संतुलन, हमारे पास है:
पांच घंटे2हे2 + 2 एमएनओ4-+ 6 एच+ → 5 ओ2 + 2 एमएन2++ 8 एच2हे
* किसी प्रतिक्रिया में परमाणुओं और आयनों के ऑक्सीकरण संख्या (Nox) की गणना कैसे करें, इस बारे में किसी भी प्रश्न के लिए, "ऑक्सीकरण संख्या (Nox) का निर्धारण" पाठ पढ़ें।
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-envolvendo-agua-oxigenada.htm
