सहसंयोजक बंधन तब होता है जब दो परमाणु इलेक्ट्रॉनों के जोड़े को साझा करते हैं ताकि एक के इलेक्ट्रॉन विन्यास को प्राप्त किया जा सके नोबल गैस (वैलेंस शेल में 8 इलेक्ट्रॉनों के साथ या 2 के साथ, केवल K शेल वाले लोगों के मामले में), के नियम के अनुसार अष्टक
हालाँकि, सहसंयोजक बंधों के विशेष मामले हैं जिनमें साझा इलेक्ट्रॉन जोड़ी केवल एक परमाणु से आती है जो पहले से ही स्थिर है. पहले, इस प्रकार के सहसंयोजक बंधन को कहा जाता था संप्रदान कारक, आज इसे अधिक सामान्यतः कहा जाता है समन्वय.
यह कैसे होता है इसे समझने के लिए कुछ उदाहरण देखें:
- सीओ (कार्बन मोनोऑक्साइड):
कार्बन के संयोजकता कोश में 4 इलेक्ट्रॉन होते हैं। इसलिए, ऑक्टेट नियम के अनुसार, स्थिर होने के लिए, इसे 4 और इलेक्ट्रॉनों को प्राप्त करने की आवश्यकता होती है, कुल मिलाकर 8। दूसरी ओर, ऑक्सीजन के वैलेंस शेल में 6 इलेक्ट्रॉन होते हैं और महान गैस नियॉन का विन्यास प्राप्त करने के लिए 2 इलेक्ट्रॉनों को प्राप्त करने की आवश्यकता होती है।
तो, सबसे पहले, कार्बन और ऑक्सीजन दो जोड़ी इलेक्ट्रॉनों को साझा करते हैं ताकि ऑक्सीजन स्थिर रहे:
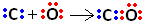
हालाँकि, कार्बन अस्थिर रहता है क्योंकि इसमें अभी भी 6 इलेक्ट्रॉन हैं और 2 की आवश्यकता है इसलिए, ऑक्सीजन, जो पहले से ही स्थिर है, अपने इलेक्ट्रॉनों के एक जोड़े को कार्बन के साथ साझा करती है, यानी यह इसके साथ एक मूल बंधन बनाती है, जिससे यह स्थिर हो जाता है:

ध्यान दें कि समन्वय सहसंयोजक बंधन को सामान्य सहसंयोजक बंधन की तरह ही डैश द्वारा दर्शाया जा सकता है।
- केवल2 (सल्फर डाइऑक्साइड):
प्रत्येक सल्फर और ऑक्सीजन परमाणु के वैलेंस शेल में 6 इलेक्ट्रॉन होते हैं, इसलिए उन्हें प्रत्येक में 2 इलेक्ट्रॉन प्राप्त करने की आवश्यकता होती है। प्रारंभ में, सल्फर दो सामान्य सहसंयोजक बंधन बनाता है, दो जोड़े इलेक्ट्रॉनों को ऑक्सीजन परमाणुओं में से एक के साथ साझा करता है, दोनों 8 इलेक्ट्रॉनों के साथ स्थिर रहते हैं।
लेकिन, अन्य ऑक्सीजन परमाणु स्थिर नहीं है, इसलिए सल्फर अपने इलेक्ट्रॉनों की एक जोड़ी को इसके साथ एक समन्वित या मूल सहसंयोजक बंधन के माध्यम से साझा करता है:
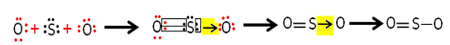
ध्यान दें कि इस मामले में हमारे पास अणु में तीन परमाणु होते हैं, इसलिए एक परमाणु से दूसरे में बंधन का प्रवास हो सकता है। सल्फर डाइऑक्साइड अणु को भी इस तरह दर्शाया जा सकता है: ओ एस ═ ओ।
हम इस संबंध घटना को कहते हैं गूंज. नीचे दी गई तालिका में तीन और उदाहरण देखें:
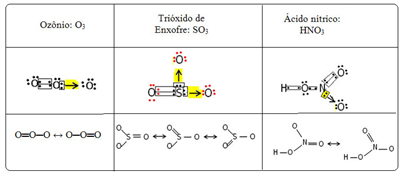
संभावित संरचनाओं को कहा जाता है अनुनाद संरचनाएं या विहित रूप.
इस प्रकार का बंधन आयनों के निर्माण में भी होता है, जैसा कि हाइड्रोनियम आयनों (H .) के मामले में होता है3हे+) और अमोनियम (NH .)4+).
सबसे पहले, एच कटियन+ यह तब बनता है जब हाइड्रोजन अपना एकल इलेक्ट्रॉन खो देता है, इसे एक सकारात्मक चार्ज के साथ छोड़ देता है। तो इसे स्थिर होने के लिए दो इलेक्ट्रॉनों को प्राप्त करने की आवश्यकता होगी। यह पानी (हाइड्रोनियम आयन के मामले में) और अमोनिया (अमोनियम आयन के मामले में) के साथ एक मूल बंधन के माध्यम से होता है। घड़ी:

जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm

