विभिन्न स्थितियों में थर्मोडायनामिक्स के पहले नियम को लागू करना सीखें, अभ्यासों को हल करें और हल किए गए और समझाए गए अभ्यासों के साथ अपने ज्ञान का परीक्षण करें।
प्रश्न 1
ऊष्मागतिकी का पहला नियम कहता है कि:
a) ऊर्जा को न तो बनाया जा सकता है और न ही नष्ट किया जा सकता है, लेकिन इसे एक रूप से दूसरे रूप में परिवर्तित किया जा सकता है।
ख) ऊर्जा हमेशा संरक्षित रहती है, लेकिन इसे एक रूप से दूसरे रूप में परिवर्तित नहीं किया जा सकता है।
ग) ऊर्जा को बनाया या नष्ट किया जा सकता है, लेकिन इसे एक रूप से दूसरे रूप में परिवर्तित नहीं किया जा सकता है।
घ) ऊर्जा को संरक्षित नहीं किया जा सकता, लेकिन इसे एक रूप से दूसरे रूप में परिवर्तित किया जा सकता है।
ऊष्मागतिकी का पहला नियम एक प्रणाली में ऊर्जा के संरक्षण का सिद्धांत है बंद होने पर, ऊर्जा की मात्रा स्थिर रहती है और इसे केवल एक रूप से दूसरे रूप में परिवर्तित किया जा सकता है। अन्य।
प्रश्न 2
एक बंद प्रणाली मान लें जो 50 J कार्य करते समय 100 J ऊष्मा प्राप्त करती है। सिस्टम की आंतरिक ऊर्जा में क्या परिवर्तन होता है?
ए) -50जे
बी) 0जे
ग) 50 जे
घ) 100 जे
ई) 150 जे
संकेतों की जाँच करना:
प्राप्त ऊष्मा धनात्मक Q > 0 है।
किया गया कार्य सकारात्मक W > 0 है।
पहले कानून के अनुसार, हमारे पास है:
प्रश्न 3
एक आदर्श गैस प्रणाली बाहरी वातावरण के साथ 500 जूल ऊष्मा का आदान-प्रदान करती है। इस प्रक्रिया को आइसोमेट्रिक कूलिंग मानते हुए क्रमशः कार्य और आंतरिक ऊर्जा निर्धारित करें।
ए) 500 जे और 0 जे
बी) - 500 और 0 जे
सी) 0 जे और 500 जे
डी) 0 जे और - 500 जे
ई) -500 जे और 500 जे
चूँकि प्रक्रिया सममितीय है, आयतन में कोई परिवर्तन नहीं होता है, इसलिए कार्य शून्य है।
ऊष्मागतिकी के प्रथम नियम के अनुसार:
चूंकि यह शीतलन है, सिस्टम गर्मी खो देता है, इसलिए:
प्रश्न 4
एक पिस्टन-सिलेंडर प्रणाली में एक आदर्श गैस के 8 मोल को 1000 J कार्य करके संपीड़ित किया जाता है। प्रक्रिया के दौरान, बाहरी वातावरण में 400 J ऊष्मा नष्ट हो जाती है। इसकी आंतरिक ऊर्जा और इसके तापमान में परिवर्तन क्रमशः बराबर हैं
दिया गया है: आर = 8.31 जे/मोल। क
ए) - 1400 जे और 6 के की अनुमानित भिन्नता
बी) 600 जे और 6 के की अनुमानित भिन्नता
ग) 600 J और 14 K की अनुमानित भिन्नता
d) - 1400 J और 14 K की अनुमानित भिन्नता
आंतरिक ऊर्जा
जैसे ही सिस्टम कार्य प्राप्त करता है, इसका संकेत नकारात्मक होता है, साथ ही गर्मी भी, जो इस प्रक्रिया में नष्ट हो जाती है।
ऊष्मागतिकी का पहला नियम है:
मानों को प्रतिस्थापित करने पर, हमें प्राप्त होता है:
आर = 8.31 जे/मोल के
तापमान
जूल के नियम के अनुसार, हमारे पास है:
प्रश्न 5
एक आदर्श गैस 500 J कार्य करते हुए संपीड़न से गुजरती है। इस परिवर्तन के अंत में, सिस्टम की आंतरिक ऊर्जा शुरुआत की तुलना में 200 J कम बदली। गैस द्वारा विनिमयित ऊष्मा की मात्रा थी
ए) - 700 जे
बी) - 300 जे
ग) 300 जे
घ) 0जे
ई) 700 जे
चूंकि कार्य प्राप्त हुआ अर्थात प्रतिरोधी कार्य, इसका संकेत नकारात्मक है।
ऊष्मागतिकी के प्रथम नियम के समीकरण में मानों को प्रतिस्थापित करना:
प्रश्न 6
(सीईडीईआरजे 2021) एक एयर कंडीशनर में एक आदर्श गैस द्वारा निष्पादित चक्र के एक चरण में, इसकी मात्रा को स्थिर रखते हुए गैस का दबाव बढ़ाया जाता है। चक्र के इस चरण में, गैस द्वारा किया गया कार्य W, उसके द्वारा अवशोषित ऊष्मा Q की मात्रा और उसके तापमान में परिवर्तन ΔT क्रमशः हैं:
ए) डब्ल्यू < 0, क्यू < 0 और ΔT < 0
बी) डब्ल्यू = 0, क्यू > 0 और ΔT > 0
सी) डब्ल्यू = 0, क्यू = 0 और ΔT = 0
d) W > 0, Q > 0 और ΔT > 0
आंकड़े:
दबाव पी बढ़ता है;
आयतन स्थिर रहता है;
काम
चूँकि आयतन स्थिर है, कार्य W शून्य के बराबर है।
ऊष्मागतिकी का पहला नियम इस प्रकार है:
चूँकि ऊष्मा धनात्मक है, आंतरिक ऊर्जा में परिवर्तन भी धनात्मक होगा।
गर्मी
चूँकि ऊष्मा अवशोषित हो जाती है, इसलिए यह सकारात्मक है।
तापमान
गैस कानून द्वारा:
कहाँ,
n मोल्स की संख्या है
R सार्वभौमिक गैस स्थिरांक है
इस प्रकार, तापमान केवल दबाव पर निर्भर करता है, क्योंकि आयतन स्थिर है, सकारात्मक है।
प्रश्न 7
(UNICENTRO 2018) थर्मोडायनामिक्स के पहले नियम के अनुसार, किसी सिस्टम की आंतरिक ऊर्जा में परिवर्तन, ΔU, है बाहरी वातावरण के साथ आदान-प्रदान की गई गर्मी, क्यू और प्रक्रिया में किए गए कार्य, डब्ल्यू के बीच अंतर द्वारा दिया गया है थर्मोडायनामिक. इस जानकारी को ध्यान में रखते हुए, यदि एक मोनोआटोमिक गैस का विस्तार होता है ताकि वह हमेशा एक ही तापमान पर रहे, तो इस परिवर्तन को समीकरण द्वारा दर्शाया जा सकता है
ए) ΔU + डब्ल्यू = 0
बी) Δयू - डब्ल्यू = 0
सी) क्यू - डब्ल्यू = 0
डी) क्यू + Δयू = 0
इज़ोटेर्मल प्रक्रिया तापमान परिवर्तन के बिना होती है।
ऊर्जा का तापमान से संबंध है:
जहाँ n मोलों की संख्या है और R सार्वभौमिक गैस स्थिरांक है। चूँकि n और R स्थिर हैं, केवल तापमान भिन्नता है, और
ऊष्मागतिकी का पहला नियम इस प्रकार है:
प्रश्न 8
(यूआरसीए 2016) थर्मोडायनामिक्स के पहले नियम के अनुसार, यदि निश्चित द्रव्यमान की एक आदर्श गैस से गुजरने वाली आइसोथर्मल प्रक्रिया के दौरान, गैस निकलती है ऊष्मा की एक मात्रा जिसका परिमाण 50 कैलोरी है तो इस प्रक्रिया में आंतरिक ऊर्जा में परिवर्तन और गैस द्वारा किया गया कार्य है, क्रमश:
ए) 0 और 50 कैलोरी।
बी) 50 कैलोरी और 0.
ग) 0 और 0.
घ) 50 कैलोरी और -50 कैलोरी।
ई) 0 और -50 कैलोरी।
आंतरिक ऊर्जा में परिवर्तन का सीधा संबंध तापमान में परिवर्तन से होता है। चूंकि प्रक्रिया इज़ोटेर्मल है, इसलिए कोई तापमान परिवर्तन नहीं होता है .
ऊष्मागतिकी के प्रथम नियम से:
चूँकि ऊष्मा निकलती है, इसका संकेत ऋणात्मक होता है।
प्रश्न 9
(यूएफआरएन 2012) बायोमास नवीकरणीय ऊर्जा के मुख्य स्रोतों में से एक है और इसलिए, बिजली उत्पादन के लिए ईंधन के रूप में इसका उपयोग करने वाली मशीनें पर्यावरण के दृष्टिकोण से महत्वपूर्ण हैं। काम उत्पन्न करने के लिए भाप टरबाइन को चलाने के लिए बायोमास का उपयोग एक बहुत ही सामान्य उदाहरण है। किनारे पर दिया गया चित्र योजनाबद्ध रूप से एक सरलीकृत थर्मोइलेक्ट्रिक पावर प्लांट को दर्शाता है।
इस थर्मोइलेक्ट्रिक प्लांट में भट्ठी में बायोमास जलाने से गर्मी पैदा होती है, जो बॉयलर में पानी को गर्म करती है और उच्च दबाव वाली भाप उत्पन्न करती है। बदले में, भाप को पाइपों के माध्यम से टरबाइन तक ले जाया जाता है, जो अपनी कार्रवाई के तहत अपने ब्लेड को घुमाना शुरू कर देता है।
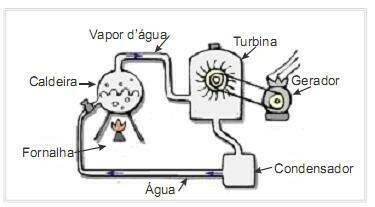
इस ताप इंजन के हिस्सों और पर्यावरण के बीच तापमान अंतर के कारण होने वाली गर्मी की हानि को नगण्य मानें। इस संदर्भ में, बॉयलर के पानी की आंतरिक ऊर्जा में भिन्नता
a) बायोमास को जलाने और टरबाइन पर किए गए कार्य से इसे आपूर्ति की गई गर्मी के योग से अधिक है।
बी) टरबाइन पर किए गए कार्य के साथ बायोमास को जलाने से इसे आपूर्ति की गई गर्मी के योग के बराबर है।
ग) बायोमास को जलाने से इसे आपूर्ति की गई गर्मी और टरबाइन पर किए गए कार्य के बीच अंतर के बराबर है।
d) बायोमास को जलाने से प्राप्त होने वाली गर्मी और टरबाइन पर किए गए कार्य के बीच के अंतर से अधिक है।
बॉयलर में पानी ईंधन जलाने से ऊष्मा के रूप में ऊर्जा प्राप्त करता है और टरबाइन पर किए गए कार्य के रूप में ऊर्जा छोड़ता है।
प्रश्न 10
(यूईसीई 2021) गैसों के गुणों के संबंध में निम्नलिखित कथनों पर ध्यान दें:
मैं। एक आदर्श गैस के लिए, आंतरिक ऊर्जा केवल दबाव का एक कार्य है।
द्वितीय. अपनी अवस्था बदलते समय गैस द्वारा अवशोषित ऊष्मा प्रक्रिया से स्वतंत्र होती है।
तृतीय. एक आदर्श गैस की आंतरिक ऊर्जा केवल तापमान पर निर्भर करती है और प्रक्रिया से स्वतंत्र होती है।
चतुर्थ. किसी आदर्श गैस के समतापीय विस्तार में, उसके द्वारा किया गया कार्य अवशोषित ऊष्मा के बराबर होता है।
जो कहा गया है वही सही है
ए) मैं और द्वितीय।
बी) III और IV।
ग) मैं और चतुर्थ।
घ) द्वितीय और तृतीय।
तृतीय. सही। एक आदर्श गैस की आंतरिक ऊर्जा केवल तापमान पर निर्भर करती है और प्रक्रिया से स्वतंत्र होती है।
आंतरिक ऊर्जा में परिवर्तन का सीधा संबंध तापमान में परिवर्तन से होता है।
जहां n मोलों की संख्या है और R आदर्श गैस स्थिरांक है, स्थिरांक होने के कारण केवल तापमान ही गैस की आंतरिक ऊर्जा निर्धारित करता है।
चतुर्थ. सही। किसी आदर्श गैस के समतापीय विस्तार में, उसके द्वारा किया गया कार्य अवशोषित ऊष्मा के बराबर होता है।
चूँकि यह समतापीय है, तापमान में कोई परिवर्तन नहीं होता है, इसलिए आंतरिक ऊर्जा में परिवर्तन शून्य है। ऊष्मागतिकी के प्रथम नियम के अनुसार:
इसके साथ और जानें:
- ऊष्मप्रवैगिकी का पहला नियम
- ऊष्मप्रवैगिकी: कानून, अवधारणाएँ, सूत्र और अभ्यास
- ऊष्मागतिकी पर अभ्यास
- गैस कानून
एएसटीएच, राफेल. ऊष्मागतिकी के प्रथम नियम का अभ्यास।सब मायने रखता है, [रा।]. में उपलब्ध: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. यहां पहुंचें:
आप भी देखें
- ऊष्मागतिकी पर अभ्यास
- ऊष्मप्रवैगिकी
- रुद्धोष्म परिवर्तन
- थर्मोकैमिस्ट्री पर अभ्यास
- ऊष्मप्रवैगिकी का पहला नियम
- प्राकृतिक विज्ञान और उनकी प्रौद्योगिकियाँ: एनेम
- थर्मल ऊर्जा
- ऊष्मप्रवैगिकी का दूसरा नियम
