तक आवर्त सारणी परिवार तालिका के ऊर्ध्वाधर अनुक्रम हैं और एकत्रित होते हैं रासायनिक तत्व समान रासायनिक गुणों के साथ. ऐसी समानताएँ एक ही परिवार में समूहीकृत तत्वों के लिए समान मात्रा में वैलेंस इलेक्ट्रॉनों की उपस्थिति के कारण होती हैं। परिवार समूह 1 और 2 में प्रतिनिधि तत्वों को, 13 से 18 तक और समूह 1 से 12 में संक्रमणकालीन तत्वों को समायोजित करते हैं।
यह भी पढ़ें:ट्रांसयूरेनिक तत्व - मानव निर्मित रासायनिक तत्व जो आवर्त सारणी में यूरेनियम के बाद आते हैं
इस लेख के विषय
- 1 - आवर्त सारणी परिवारों का सारांश
- 2 - आवर्त सारणी परिवारों का संगठन
-
3 - आवर्त सारणी परिवारों का नामकरण
- → आवर्त सारणी के प्रतिनिधि तत्व
- → आवर्त सारणी संक्रमण तत्व
- 4 - आवर्त सारणी परिवारों के रासायनिक तत्व
-
5 - आवर्त सारणी परिवारों की मुख्य विशेषताएँ
- → समूह 1 या क्षार धातुओं का परिवार
- → समूह 2 या क्षारीय पृथ्वी धातुओं का परिवार
- → समूह 3 से 12 या संक्रमण धातुओं का परिवार
- → समूह 13 या बोरॉन परिवार
- → समूह 14 या कार्बन परिवार
- → समूह 15 या नाइट्रोजन परिवार
- → समूह 16 या ऑक्सीजन परिवार (चॉकोजेन)
- → समूह 17 या हैलोजन का परिवार
- → समूह 18 या नोबल गैस परिवार
-
6 - आवर्त सारणी और इलेक्ट्रॉनिक वितरण
- → प्रतिनिधि तत्वों का इलेक्ट्रॉनिक वितरण
- → संक्रमण तत्वों का इलेक्ट्रॉनिक वितरण
- 7 - आवर्त सारणी के परिवारों पर हल किए गए अभ्यास
आवर्त सारणी परिवारों का सारांश
परिवार की ऊर्ध्वाधर रेखाओं के अनुरूप हैं आवर्त सारणी.
समूहों के रूप में भी जाना जाता है, आवर्त सारणी में परिवारों की संख्या 1 से 18 तक होती है।
एक ही परिवार के रासायनिक तत्वों के रासायनिक गुण समान होते हैं।
तत्वों के एक समूह की परिचितता को समान संख्या में वैलेंस इलेक्ट्रॉनों द्वारा समझाया गया है।
प्रतिनिधि तत्वों को समूह 1, 2, 13, 14, 15, 16, 17 और 18 में विभाजित किया गया है। इनमें से प्रत्येक परिवार के विशिष्ट नाम हैं।
संक्रमण तत्व एक एकल परिवार बनाते हैं जो समूह 3, 4, 5, 6, 7, 8, 9, 10, 11 और 12 में विभाजित है।
अब मत रोको... प्रचार के बाद और भी बहुत कुछ है ;)
आवर्त सारणी परिवारों का संगठन
आवर्त सारणी में परिवार तालिका के ऊर्ध्वाधर क्रम हैं, यानी, कॉलम। आवर्त सारणी के परिवारों को समूह के रूप में भी जाना जाता है बाएँ से दाएँ 1 से 18 तक क्रमांकित हैं।
एक ही स्तंभ पर कब्जा करने वाले रासायनिक तत्वों को एक ही परिवार में माना जाता है।, उनके रासायनिक गुणों के बीच समानता के कारण, जो इस तथ्य के कारण है कि उनकी संख्या समान है इलेक्ट्रॉनों पर रासायनिक संयोजन शेल. उदाहरण के लिए, परिवार 18 के सभी रासायनिक तत्वों के संयोजकता कोश (पूर्ण कोश) में आठ इलेक्ट्रॉन होते हैं और वे शायद ही कभी इसमें भाग लेते हैं रासायनिक बन्ध.
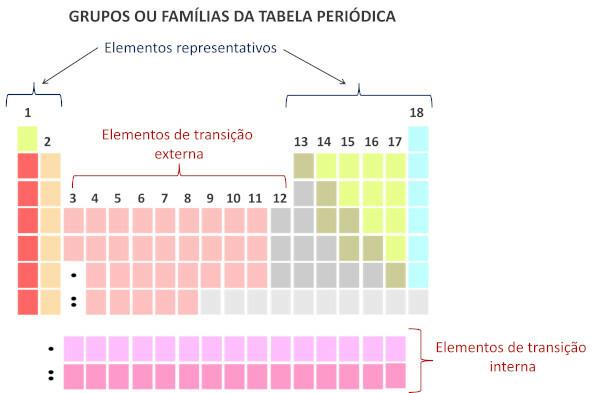
की आधुनिक प्रणाली के अनुसार शुद्ध और व्यावहारिक रसायन के अंतर्राष्ट्रीय संघ (आईयूपीएसी), प्रत्येक समूह या परिवार को आवर्त सारणी में बाएं से दाएं शुरू करते हुए 1 से 18 तक की संख्या से पहचाना जाता है।
यह उजागर करना महत्वपूर्ण है कि पुरानी IUPAC प्रणाली ने क्रमशः प्रतिनिधि और संक्रमण तत्वों को संदर्भित करने के लिए अक्षर A और B के साथ एक अल्फ़ान्यूमेरिक प्रणाली अपनाई थी। वर्तमान में, इस प्रकार के नामकरण का अब उपयोग नहीं किया जाता है।
आवर्त सारणी परिवारों का नामकरण
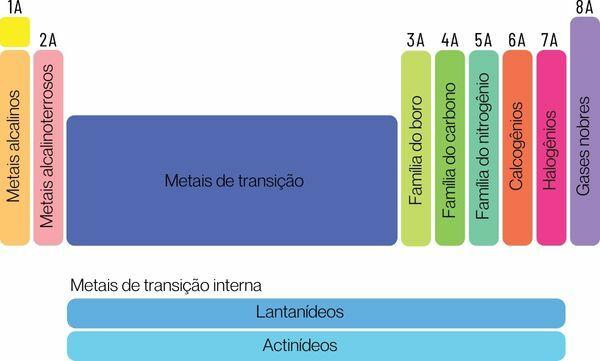
रासायनिक तत्वों को दो बड़े परिवारों में वर्गीकृत किया जा सकता है: प्रतिनिधि तत्व और संक्रमण तत्व।
→ आवर्त सारणी के प्रतिनिधि तत्व
प्रतिनिधि तत्वों को समूह 1, 2, 13, 14, 15, 16, 17 और 18 में विभाजित किया गया है। इनमें से प्रत्येक समूह का एक विशिष्ट नाम होता है, जिससे उसे जाना भी जा सकता है। देखना:
समूह 1: का परिवार धातुओं क्षारीय.
समूह 2: का परिवार क्षारीय पृथ्वी धातु.
समूह 13: बोरॉन या पृथ्वी धातु परिवार।
समूह 14: कार्बन परिवार.
समूह 15: नाइट्रोजन या पैनिकोजेन्स परिवार।
समूह 16: ऑक्सीजन या चाकोजेन परिवार।
समूह 17: का परिवार हैलोजन.
समूह 18: का परिवार उत्कृष्ट गैस.
→ आवर्त सारणी संक्रमण तत्व
आप संक्रमण तत्वसमूह 3, 4, 5, 6, 7, 8, 9, 10, 11 और 12 में विभाजित एक एकल परिवार बनाएं. लैंथेनाइड और एक्टिनाइड श्रृंखला भी संक्रमण तत्वों का हिस्सा हैं।
संक्रमण तत्व सभी धात्विक हैं और इनमें समान रासायनिक गुण हैं, यहां तक कि वैलेंस शेल में अलग-अलग इलेक्ट्रॉन होते हैं और इसलिए, संक्रमण धातुओं का एक एकल और बड़ा परिवार बनाते हैं।
आवर्त सारणी के परिवारों से रासायनिक तत्व
प्रत्येक परिवार या समूह रासायनिक तत्वों के एक समूह से बना है। प्रत्येक परिवार को बनाने वाले रासायनिक तत्वों का विवरण देखें:
समूह 1:लिथियम, सोडियम, पोटैशियम, रूबिडीयाम, सीज़ियम, फ्रैनशियम.
समूह 2:फीरोज़ा, मैगनीशियम, कैल्शियम, स्ट्रोंटियम, बेरियम, रेडियो.
समूह 3:स्कैंडियम, yttrium, लैंथेनाइड श्रृंखला और एक्टिनाइड श्रृंखला।
समूह 4: टाइटेनियम, zirconiaहे, हेफ़नियम यह है रदरफोर्डियम.
समूह 5:वैनेडियम, नाइओबियम, टैंटलम यह है dubnium.
समूह 6:क्रोम, मोलिब्डेनम, टंगस्टन यह है सीबोर्गियम.
समूह 7:मैंगनीज, टेक्नेटियम, रेनीयाम यह है बोहरिओ.
समूह 8: लोहा, दयाता, आज़मियम यह है हैसियम.
समूह 9:कोबाल्ट, रोडियम, इरिडियम और मीटनेरियम।
समूह 10:निकल, पैलेडियम, प्लैटिनम और darmstadtio.
समूह 11: ताँबा, चाँदी, सोना और रेंटजेनियम।
समूह 12:जस्ता, कैडमियम, बुध और कॉपरनिकस.
समूह 13: बोरान, अल्युमीनियम, गैलियम, इंडियम और थैलियम।
समूह 14: कार्बन, सिलिकॉन, जर्मेनियम, टिन, नेतृत्व करना और फ्लेरोवियम.
समूह 15:नाइट्रोजन, भास्वर, हरताल, सुरमा यह है विस्मुट.
समूह 16:ऑक्सीजन, गंधक, सेलेनियम, टेल्यूरियम, पोलोनियम और लिवरमोरियम।
समूह 17: एक अधातु तत्त्व, क्लोरीन, ब्रोमीन, आयोडीन और अस्थैतिक.
समूह 18:हीलियम, नियोन, आर्गन, क्रीप्टोण, क्सीनन यह है रेडॉन.
महत्वपूर्ण: रासायनिक तत्व हाइड्रोजन यह एक विशेष मामला है, क्योंकि समूह 1 के बगल में स्थित होने के बावजूद, यह क्षार धातु परिवार का हिस्सा नहीं है, क्योंकि यह समान रासायनिक गुणों को साझा नहीं करता है।
अधिक जानते हैं: आवर्त सारणी में रेडियोधर्मी तत्व कौन से हैं?
आवर्त सारणी के परिवारों की मुख्य विशेषताएँ
वे धात्विक ठोस, चमकदार और चिकने होते हैं।
उनके पास उच्च तापीय चालकता और उच्च है विद्युत चालकता.
पास तापमान अपेक्षाकृत कम पिघलना।
वे अत्यधिक प्रतिक्रियाशील हैं पानी.
मोनोवालेंट धनायन (आवेश +1) बनाने की प्रवृत्ति।
वे क्षार धातुओं की तुलना में धात्विक ठोस, चमकदार और कठोर होते हैं।
वे आसानी से ऑक्सीकरण करते हैं।
इनमें उच्च तापीय चालकता और उच्च विद्युत चालकता होती है।
क्षार धातुओं की तुलना में उनका पिघलने का तापमान थोड़ा अधिक होता है।
ये पानी के साथ प्रतिक्रियाशील होते हैं।
द्विसंयोजी धनायन बनाने की प्रवृत्ति (आवेश +2)।
वे आवर्त सारणी पर सबसे बड़ा परिवार हैं।
कठोर, चमकदार धात्विक ठोस।
इनमें उच्च तापीय चालकता और उच्च विद्युत चालकता होती है।
सघन।
उच्च पिघलने का तापमान.
भिन्न प्रस्तुत कर सकते हैं ऑक्सीकरण अवस्थाएँ.
→ समूह 13 या बोरॉन परिवार
इनमें धातुओं के गुणों के बीच मध्यवर्ती गुण होते हैं धातु नहीं.
वे परिवेशीय परिस्थितियों में ठोस होते हैं।
त्रिसंयोजक धनायन बनाने की प्रवृत्ति (आवेश +3)।
→ समूह 14 या कार्बन परिवार
इनमें धातुओं और अधातुओं के गुणों के बीच मध्यवर्ती गुण होते हैं।
वे परिवेशीय परिस्थितियों में ठोस होते हैं।
चार बंधन बनाने की प्रवृत्ति.
वे परिवेशीय परिस्थितियों में ठोस होते हैं।
कार्बन और सिलिकॉन श्रृंखला बंधन बना सकते हैं।
→ समूह 15 या नाइट्रोजन परिवार
इनमें धातुओं और अधातुओं के गुणों के बीच मध्यवर्ती गुण होते हैं।
परिवेशी परिस्थितियों में ठोस, नाइट्रोजन के अपवाद के साथ, जो एक गैस है।
नाइट्रोजन और फास्फोरस जीवित जीवों के लिए मौलिक हैं।
आर्सेनिक अत्यधिक विषैला होता है।
→ समूह 16 या ऑक्सीजन परिवार (चॉकोजेन)
उनके अलग-अलग गुण होते हैं, जैसे-जैसे आप परिवार में नीचे जाते हैं, वे गैर-धात्विक से धात्विक तत्व में बदलते जाते हैं।
परिवेशी परिस्थितियों में ठोस, ऑक्सीजन के अपवाद के साथ, जो एक गैस है।
द्विसंयोजी ऋणायन (आवेश-2) बनाने की प्रवृत्ति।
→ समूह 17 या हैलोजन का परिवार
वे अधातु हैं।
काफी प्रतिक्रियाशील.
खराब थर्मल और विद्युत कंडक्टर।
परिवेशीय परिस्थितियों में, फ्लोरीन और क्लोरीन मौजूद होते हैं गैसों, ब्रोमीन तरल है और आयोडीन ठोस है।
मोनोवालेंट आयन बनाने की प्रवृत्ति (चार्ज -1)।
→ समूह 18 या नोबल गैस परिवार
वे अधातु हैं।
बहुत कम प्रतिक्रियाशील होती हैं, इसलिए इन्हें अक्रिय गैसें कहा जा सकता है।
वे गैसों के रूप में मौजूद हैं।
उनमें बनने की प्रवृत्ति नहीं होती आयनों.
आवर्त सारणी और इलेक्ट्रॉनिक वितरण
एक ही परिवार या समूह से संबंधित रासायनिक तत्वों के रासायनिक गुण समान होते हैं क्योंकि उनके पास होते हैं संयोजकता कोश में इलेक्ट्रॉनों की समान संख्या।
संयोजकता कोश में इलेक्ट्रॉनों की संख्या प्रासंगिक है, क्योंकि यह धनायनों के निर्माण की प्रवृत्ति को निर्धारित करती है आयन, बनने वाले रासायनिक बंधन का प्रकार, रासायनिक प्रतिक्रियाओं में शामिल ऊर्जा, आदि विशेषताएँ। वैलेंस इलेक्ट्रॉनों की संख्या ज्ञात करने के लिए, जानना आवश्यक है परमाणु संख्या तत्व का और अपना प्रदर्शन करें इलेक्ट्रॉनिक वितरण.
→ प्रतिनिधि तत्वों का इलेक्ट्रॉनिक वितरण
प्रतिनिधि तत्व उपस्तरों में उनके सबसे ऊर्जावान इलेक्ट्रॉन होते हैं एस यह है पी इलेक्ट्रॉनिक परत का (एन)। निम्नलिखित तालिका प्रतिनिधि तत्वों के प्रत्येक परिवार से जुड़े इलेक्ट्रॉनिक विन्यास को एक साथ लाती है। शब्द एन 1 से 7 तक भिन्न होता है और वैलेंस इलेक्ट्रॉनों द्वारा व्याप्त ऊर्जा स्तर का प्रतिनिधित्व करता है, जो आवर्त सारणी की अवधि (क्षैतिज रेखा) के बराबर है जिसमें तत्व पाया जाता है।
प्रतिनिधि तत्वों का इलेक्ट्रॉनिक वितरण | ||
परिवार या समूह |
इलेक्ट्रॉनिक वितरण |
उदाहरण |
1 |
हम1 |
ली (Z=3): 1s2 2s1 |
2 |
हम2 |
हो (Z=4): 1s2 2s2 |
13 |
हम2 एनपी1 |
बी (जेड=5): 1एस2 2s22पी1 |
14 |
हम2 एनपी2 |
सी (जेड=6): 1एस2 2s22पी2 |
15 |
हम2 एनपी3 |
एन (जेड=7): 1एस2 2s22पी3 |
16 |
हम2 एनपी4 |
ओ (जेड=8): 1एस2 2s22पी4 |
17 |
हम2 एनपी5 |
एफ (जेड=9): 1एस2 2s22पी5 |
18 |
हम2 एनपी6 |
Ne (Z=10): 1s2 2s22पी6 |
→ संक्रमण तत्वों का इलेक्ट्रॉनिक वितरण
संक्रमण तत्वों को समूह 3 और 12 के बीच वितरित किया जाता है उपस्तर हैं डी यह है एफ वैलेंस इलेक्ट्रॉनों द्वारा कब्जा कर लिया गया:
बाहरी संक्रमण तत्व: वैलेंस इलेक्ट्रॉनों को उपस्तर में रखें डी, इलेक्ट्रॉन विन्यास को बराबर रखते हुए हम2 (एन-1)डी(1 से 8). उदाहरण के लिए, तत्व निकल (Z = 28) समूह 10 से संबंधित है, और इसका विन्यास 1s है2 2s2 2पी6 3s2 3पी6 4s2 3डी8.
आंतरिक संक्रमण तत्व: वे समूह 3 का हिस्सा हैं, लेकिन आवर्त सारणी के "आंतरिक" हैं, जिसका विस्तार इसके नीचे, अवधि 6 (लैंथेनाइड्स) और 7 (एक्टिनाइड्स) में किया जा रहा है। इन तत्वों के उपकोश में वैलेंस इलेक्ट्रॉन होते हैं एफ और का सामान्य इलेक्ट्रॉनिक विन्यास हम2 (एन-2)एफ(1 से 13). उदाहरण के लिए, तत्व लैंथेनम (Z = 57) लैंथेनाइड श्रृंखला में पहला तत्व है, और इसका इलेक्ट्रॉन विन्यास 1s है2 2s2 2पी6 3s2 3पी6 4s2 3डी10 4पी6 5s2 4डी10 5पी6 6s2 4एफ1.
यह भी जानें:आवर्त सारणी की उत्पत्ति क्या है?
आवर्त सारणी के परिवारों पर हल किए गए अभ्यास
प्रश्न 1
(यूएफसी - अनुकूलित) तत्वों के आधुनिक आवधिक वर्गीकरण के संबंध में, सत्य कथन पर निशान लगाएं:
ए) आवर्त सारणी में, परिवार या समूह क्षैतिज रेखाओं के अनुरूप होते हैं।
बी) एक परिवार के तत्वों में बहुत भिन्न रासायनिक गुण होते हैं।
सी) एक परिवार में, तत्वों के अंतिम कोश में आमतौर पर इलेक्ट्रॉनों की संख्या समान होती है।
D) किसी आवर्त में तत्वों के रासायनिक गुण समान होते हैं।
ई) प्रतिनिधि तत्वों को समूह 3 से 12 में वितरित किया जाता है।
संकल्प:
वैकल्पिक सी
आइटम ए गलत है: परिवार या समूह आवर्त सारणी के स्तंभ (ऊर्ध्वाधर रेखाएं) हैं।
आइटम बी और डी गलत: एक परिवार में, तत्वों के रासायनिक गुण समान होते हैं। आवर्तों में, तत्वों में वैलेंस इलेक्ट्रॉनों द्वारा व्याप्त समान इलेक्ट्रॉन आवरण होता है।
आइटम सी सही: एक परिवार में, तत्वों के अंतिम कोश में इलेक्ट्रॉनों की संख्या समान होती है।
आइटम ई गलत: प्रतिनिधि तत्व समूह 1, 2, 13, 14, 15, 16, 17 और 18 हैं। संक्रमण तत्वों को समूह 3 से 12 में वितरित किया जाता है।
प्रश्न 2
(ईएएम) तत्व ए, बी और सी के संयोजकता कोश में निम्नलिखित इलेक्ट्रॉन विन्यास हैं:
ए: 3एस1
बी: 4s2 4पी4
सी: 3एस2
इस जानकारी के आधार पर सही विकल्प का चयन करें।
ए) तत्व ए एक क्षार धातु है।
बी) तत्व बी एक हैलोजन है।
सी) तत्व सी एक चाकोजेन है।
डी) तत्व ए और बी आवर्त सारणी के तीसरे आवर्त से संबंधित हैं।
ई) तीन तत्व आवर्त सारणी के एक ही समूह से संबंधित हैं।
संकल्प:
वैकल्पिक ए
आइटम ए सही है: तत्व ए में इलेक्ट्रॉनिक वितरण होता है जिसमें केवल एक वैलेंस इलेक्ट्रॉन होता है, इसलिए यह आवर्त सारणी के समूह 1 से संबंधित है।
ग़लत आइटम B: तत्व B में 4s इलेक्ट्रॉन विन्यास है2 4पी4, यह दर्शाता है कि अंतिम कोश में 6 इलेक्ट्रॉन हैं और यह तत्व समूह 16 (चॉकोजेन) से संबंधित है।
गलत आइटम सी: तत्व सी में अंतिम कोश में 2 इलेक्ट्रॉनों के साथ एक इलेक्ट्रॉनिक विन्यास है, इसलिए यह तालिका में समूह 2 का एक तत्व है।
गलत आइटम डी: तत्व ए तीसरी अवधि (एन = 3) से संबंधित है, और तत्व बी चौथी अवधि (एन = 4) से संबंधित है।
गलत आइटम E: तीनों तत्वों के अंतिम कोश में इलेक्ट्रॉनों की मात्रा अलग-अलग है, इसलिए वे एक ही परिवार का हिस्सा नहीं हो सकते।
एना लुइज़ा लोरेंजेन लीमा द्वारा
रसायन विज्ञान शिक्षक
यहां क्लिक करें, जानें कि वैलेंस परत क्या है और जानें कि इसे कैसे पहचाना जा सकता है।
समझें कि इलेक्ट्रॉनिक वितरण कैसे किया जाता है और उदाहरण देखें।
आंतरिक संक्रमण तत्वों (एक्टिनाइड्स और लैंथेनाइड्स) की विशिष्टताओं के बारे में जानें, जो आवर्त सारणी के समूह 3 की छठी और सातवीं अवधि पर कब्जा करते हैं।
मौजूदा रासायनिक तत्वों को जानें, समझें कि वे क्या हैं और उनका प्रतिनिधित्व कैसे करें।
उत्कृष्ट गैसें प्रकृति में पृथक रूप में पाए जाने वाले एकमात्र तत्व हैं। इस लेख में उनके बारे में और जानें!
हैलोजन, उनके गुणों, विशेषताओं और रोजमर्रा की जिंदगी में उनके मुख्य उपयोगों के बारे में जानें।
क्षारीय पृथ्वी धातुओं के बारे में और अधिक जानें, विशेषताओं, गुणों और अनुप्रयोगों को जानें।
समझें कि परमाणु संख्या क्या है और जानें कि परमाणु की कौन सी विशेषताएँ इससे निर्धारित की जा सकती हैं।
यहां जांचें कि आवर्त सारणी क्या है और इसे बनाने वाले सभी रासायनिक तत्वों को जानने के लिए एक इंटरैक्टिव मॉडल देखें।