NS तापीय धारिता एक थर्मोडायनामिक फ़ंक्शन है जिसके द्वारा समदाब रेखीय प्रक्रियाओं में शामिल ऊष्मा की गणना करता हैयानी लगातार दबाव में रखा जाता है। इसका विकास कैलोरी सिद्धांत के पतन के तुरंत बाद हुआ, की उन्नति के साथ ऊष्मप्रवैगिकी 1840 और 1850 के बीच।
थैलेपी, के लिए क्यायूमिका, यदि इसे एक निरपेक्ष और पृथक मूल्य के रूप में काम किया जाता है, तो इसका अधिक अर्थ नहीं है, लेकिन यह विचार करते समय होता है रासायनिक प्रक्रिया में इसके मूल्य की भिन्नता. एक प्रक्रिया की एन्थैल्पी भिन्नता की गणना करने के कई तरीके हैं, जिनमें से मुख्य हैं गठन की ऊर्जा के माध्यम से, बंधन और द्वारा भी। वहांअरे हेस से.
यह भी पढ़ें: गिब्स फ्री एनर्जी क्या है?
एन्थैल्पी सारांश
एन्थैल्पी एक थर्मोडायनामिक उपकरण है जो निरंतर दबाव में होने वाली प्रक्रियाओं में शामिल गर्मी की गणना के लिए है।
इसे अमेरिकी भौतिक विज्ञानी योशिय्याह डब्ल्यू. गिब्स, कैलोरी सिद्धांत के पतन के संदर्भ में।
रसायन विज्ञान में, हम हमेशा थैलेपी परिवर्तन का उपयोग करते हैं, जिसे H के रूप में दर्शाया जाता है।
गर्मी को अवशोषित करने वाली रासायनिक प्रतिक्रियाओं को एंडोथर्मिक कहा जाता है और इसमें ΔH> 0 होता है।
रासायनिक अभिक्रियाएँ जो ऊष्मा छोड़ती हैं, ऊष्माक्षेपी कहलाती हैं और इनमें ΔH <0 होता है।
एन्थैल्पी पर वीडियो पाठ
एन्थैल्पी क्या है?
एन्थैल्पी, जिसे सदैव H द्वारा निरूपित किया जाता है, प्रारंभ में थी अमेरिकी भौतिक विज्ञानी योशिय्याह विलार्ड गिब्स द्वारा परिभाषित, जिसे उन्होंने निरंतर दबाव समारोह में गर्मी कहा, क्योंकि, उनके शब्दों में:
"[...] फ़ंक्शन में कमी का प्रतिनिधित्व करता है, उन सभी मामलों में जहां दबाव भिन्न नहीं होता है, सिस्टम द्वारा दी गई गर्मी।"
गिब्स के कार्य से, हम एन्थैल्पी को एक ऊष्मागतिकीय फलन के रूप में समझ सकते हैं जिसका भिन्नता संख्यात्मक रूप से प्रणाली में आदान-प्रदान की गई गर्मी की मात्रा के बराबर है, to दबाव लगातार. इसका मतलब यह है कि, समदाब रेखीय प्रक्रियाओं में (अधिकांश रासायनिक प्रक्रियाओं की तरह), जानना एन्थैल्पी फलन की भिन्नता की गणना करें, तब प्रणाली और के बीच आदान-प्रदान की गई ऊष्मा का मान ज्ञात कर सकते हैं अड़ोस - पड़ोस।

गर्मी के साथ इस तरह के संबंध का कारण बनता है कई छात्र गलती से सोचते हैं कि थैलेपी का पर्यायवाची है तपिश या ऊर्जा सामग्री, गर्मी सामग्री, जारी गर्मी और अवशोषित गर्मी, और इसी तरह कुछ।
कैलोरी सिद्धांत के पतन के संदर्भ में उत्साह उत्पन्न हुआ, जिसने गर्मी को एक अपरिहार्य भौतिक पदार्थ के रूप में माना जो गर्म निकायों से ठंडे निकायों में स्थानांतरित हो गया। इस प्रकार, गर्मी की गणना के लिए एक नए उपकरण की आवश्यकता थी। समाधान, तब मात्राओं का उपयोग करना था जो पहले से ही थर्मोडायनामिक समीकरणों को परिभाषित कर चुके थे, जैसे कि थैलेपी।
यह भी पढ़ें: विलयन के एन्थैल्पी परिवर्तन की गणना कैसे करें?
एन्थैल्पी भिन्नता
चूँकि एन्थैल्पी एक उपकरण है जिसका उपयोग रासायनिक प्रक्रिया में विनिमय की गई ऊष्मा की गणना के लिए किया जाता है, इसलिए इसे निरपेक्ष, पृथक संख्या के रूप में उपयोग करने का कोई मतलब नहीं है, लेकिन इसकी भिन्नता पर विचार करते हुए, अर्थात्, व्यवहार में, हमें केवल यह आकलन करना चाहिए कि रासायनिक प्रक्रिया के दौरान, संख्यात्मक रूप से, थैलेपी कितना बदल गया, क्योंकि थर्मोडायनामिक्स हमें आश्वासन देता है कि इसकी भिन्नता है संख्यात्मक रूप से प्रक्रिया में जारी या अवशोषित गर्मी के बराबर.
कड़ाई से बोलते हुए, हम थैलेपी भिन्नता को इस प्रकार परिभाषित कर सकते हैं:
एच = एचअंतिम - एचप्रारंभिक
रासायनिक प्रक्रियाओं की तरह, अंतिम चरण को उत्पाद माना जा सकता है और प्रारंभिक चरण को अभिकर्मक माना जा सकता है। थैलेपी भिन्नता की परिभाषा को इस प्रकार देखना भी सामान्य है:
एच = एचउत्पादों - एचअभिकर्मकों
व्यावहारिक और व्याख्यात्मक दृष्टिकोण से, यदि एन्थैल्पी परिवर्तन धनात्मक है (एच> 0), हम कहते हैं कि रासायनिक प्रतिक्रिया है एन्दोठेर्मिकयानी पूरी प्रक्रिया के दौरान गर्मी का अवशोषण होता है। पहले से ही यदि एन्थैल्पी परिवर्तन ऋणात्मक है (एच< 0), हम कहते हैं कि रासायनिक प्रतिक्रिया है एक्ज़ोथिर्मिकयानी पूरी प्रक्रिया के दौरान गर्मी निकलती है।
कई मामलों में, एन्थैल्पी भिन्नता, ग्राफ़ में देखी जाती है, जैसा कि निम्नलिखित उदाहरणों में दिखाया गया है।
उदाहरण 1:
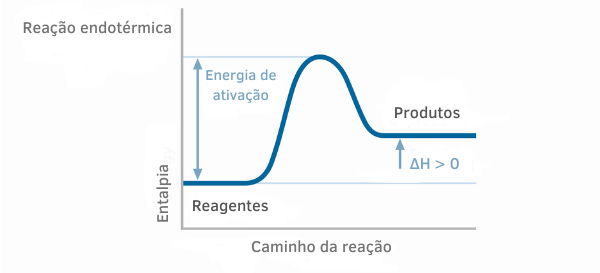
एंडोथर्मिक रिएक्शन चार्ट
एंडोथर्मिक प्रतिक्रियाओं के लिए थैलेपी ग्राफ में, यह देखा जा सकता है कि उत्पादों की थैलेपी की मात्रा अभिकारकों की तुलना में अधिक है, यह दर्शाता है कि प्रतिक्रिया के साथ भिन्नता सकारात्मक है। इस प्रकार, यदि ΔH > 0, तो हम कह सकते हैं कि रासायनिक प्रक्रिया ऊष्मा अवशोषण के साथ हुई।
उदाहरण 2:
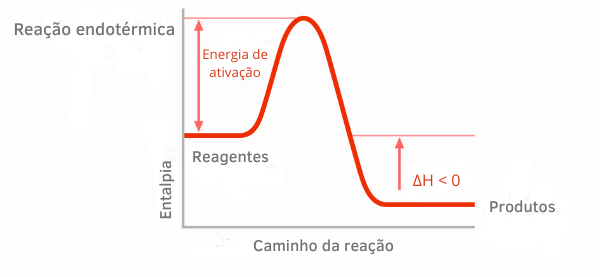
एक्ज़ोथिर्मिक प्रतिक्रिया चार्ट:
एक्ज़ोथिर्मिक प्रतिक्रियाओं के लिए थैलेपी ग्राफ में, यह देखा जा सकता है कि उत्पादों की थैलेपी की मात्रा अभिकारकों की तुलना में कम है, यह दर्शाता है कि प्रतिक्रिया के साथ भिन्नता नकारात्मक है। इस प्रकार, ΔH <0 होने के कारण, हम कह सकते हैं कि रासायनिक प्रक्रिया ऊष्मा के निकलने के साथ हुई।
पाठ में रासायनिक प्रतिक्रियाओं के इन वर्गीकरणों के बारे में और पढ़ें: के लियेएंडोथर्मिक और एक्ज़ोथिर्मिक प्रक्रियाएं.
एन्थैल्पी के प्रकार
गठन थैलीपी
NS गठन थैलीपी é गणना पर आधारित गठन रासायनिक प्रतिक्रियाएं, जो ऐसी प्रतिक्रियाएं हैं जिनमें कमरे के तापमान और दबाव के 1 वातावरण पर उनके सबसे स्थिर सरल पदार्थों से एक मोल यौगिक पदार्थ बनते हैं।
एच2(जी) + ½ ओ2 (जी) → एच2ओ (एल) एच डिग्रीएफ = -286 केजे/मोल
निर्माण की एन्थैल्पी का सबसे बड़ा लाभ यह है कि साधारण पदार्थ जो कमरे के तापमान पर अधिक स्थिर होते हैं और दबाव के 1 वातावरण में एक थैलेपी शून्य पर सहमत होती है। यह कहना नहीं है कि वे वास्तव में शून्य हैं, लेकिन, सरलीकरण और बेहतर वर्गीकरण के लिए, उनके साथ ऐसा व्यवहार किया जाता है।
हो रहा एच = एचउत्पादों - एचअभिकर्मकों, अगर हम मानते हैं, तो, एचअभिकर्मकों = 0, हम कह सकते हैं कि H का प्रेक्षित मान केवल उन उत्पादों से संबंधित है, जो इन मामलों में, यौगिक पदार्थ के हमेशा एक मोल होते हैं। इसलिए, हम इस मान को जल निर्माण की मानक एन्थैल्पी भिन्नता के रूप में तालिकाबद्ध करते हैं, जिसे H°. द्वारा प्रदर्शित किया जाता हैएफ.
यह इस पद्धति के साथ था कि कई पदार्थों के अपने रूपांतर थे मानक थैलीपी गठन सारणी, जैसा कि हम नीचे देख सकते हैं।
पदार्थ |
गठन थैलीपी (ΔH° .)एफ) kJ/mol. में |
सीओ2 (जी) |
-393,4 |
सीएओ |
-634,9 |
हाय (जी) |
+25,9 |
नहीं (जी) |
+90,1 |
बाध्यकारी थैलीपी
बाध्यकारी थैलीपी किसी दिए गए तिल के टूटने या बनने में शामिल ऊर्जा की मात्रा को इंगित करने का कार्य करती है। रसायनिक बंध.
यह समझा जाता है कि, रासायनिक बंधन को तोड़ने के लिए गर्मी को अवशोषित करना आवश्यक है, ताकि आबंधन परमाणु अपनी वृद्धि करें आंतरिक ऊर्जा और, फलस्वरूप, अपनी गतिज ऊर्जा बढ़ाएँ। बड़े के साथ गतिज ऊर्जा, परमाणु अधिक तीव्रता से कंपन करते हैं, जिससे बंधन टूट जाते हैं। इस प्रकार, प्रत्येक बंधन टूटना एक एंडोथर्मिक प्रक्रिया है।
अन्यथा, एक रासायनिक बंधन बनाने के लिए, परमाणु गति की स्वतंत्रता खो देते हैं और उनकी गति की डिग्री को कम करने की आवश्यकता होती है, जिससे उनकी गतिज ऊर्जा कम हो जाती है। अतिरिक्त ऊर्जा तब ऊष्मा के रूप में निकलती है। इस प्रकार, सभी बंधन गठन एक एक्ज़ोथिर्मिक प्रक्रिया है.
नीचे दी गई तालिका प्रत्येक रासायनिक बंधन से जुड़ी ऊर्जाओं के मूल्यों को दर्शाती है।
संबंध |
बाध्यकारी ऊर्जा (केजे / एमओएल) |
सी-हू |
412,9 |
सी-सी |
347,8 |
ओ═ओ |
497,8 |
एफ-एफ |
154,6 |
नहीं |
943,8 |
ध्यान दें कि मानों में कोई संकेत नहीं हैं, क्योंकि वे मापांक में हैं। ऐसा इसलिए है क्योंकि लिंक टूटा हुआ है या बनता है, इस पर निर्भर करते हुए सिग्नल को आपके द्वारा असाइन किया जाना चाहिए।
दहन थैलीपी
NS दहन थैलीपी इंगित करने के लिए कार्य करता है किसी पदार्थ के एक मोल के दहन में निकलने वाली ऊष्मा की मात्रा. यह ध्यान दिया जाना चाहिए कि प्रत्येक दहन प्रतिक्रिया एक्ज़ोथिर्मिक होती है, क्योंकि प्रत्येक जलने से गर्मी निकलती है।
चौधरी4 (जी) + 2 ओ2 (जी) → सीओ2 (जी) + 2 एच2H°सी = -889.5 kJ/mol
नीचे दी गई तालिका कुछ रासायनिक पदार्थों के लिए दहन मूल्यों की थैलीपी दिखाती है।
पदार्थ |
दहन थैलीपी (ΔH° .)सी) kJ/mol. में |
इथेनॉल - सी2एच5ओह (1) |
-1368 |
बेंजीन - सी6एच6 (1) |
-3268 |
ओकटाइन - सी8एच18 (1) |
-5471 |
ग्लूकोज - सी6एच12हे6 (एस) |
-2808 |
भौतिक अवस्था परिवर्तन की एन्थैल्पी
भौतिक अवस्था में प्रत्येक परिवर्तन में ऊष्मा विनिमय शामिल होता है। इसलिए भौतिक अवस्था में परिवर्तन की एन्थैल्पी इंगित करने के लिए कार्य करता है भौतिक अवस्था परिवर्तन प्रक्रियाओं में शामिल ऊष्मा की मात्रा.
उदाहरण के लिए, हमारे पास जल वाष्पीकरण है:
एच2ओ (1) → एच2हे (जी) H = +44 kJ/mol
पानी के पिघलने में, हमारे पास है:
एच2हे(रों) → एच2हे (एल) H = +7.3 kJ/mol
प्रतिलोम प्रक्रियाओं के लिए एन्थैल्पी मान सममित होते हैं, जिसका अर्थ है कि, उदाहरण के लिए, पानी के द्रवीकरण में एन्थैल्पी परिवर्तन -44 kJ/mol है, जबकि, इसके जमने में, यह -7.3 kJ/mol के बराबर है।
यह भी पढ़ें: एन्ट्रापी क्या है?
एन्थैल्पी पर हल किए गए व्यायाम
प्रश्न 1 - (यूईआरजे 2018) ईंधन के रूप में उपयोग किए जाने वाले हाइड्रोकार्बन की प्रदूषण क्षमता का निर्धारण जारी ऊर्जा और सीओ की मात्रा के बीच के अनुपात से होता है।2 इसके पूर्ण दहन में गठित। अनुपात जितना अधिक होगा, प्रदूषण क्षमता उतनी ही कम होगी। नीचे दी गई तालिका चार हाइड्रोकार्बन के दहन की मानक एन्थैल्पी दर्शाती है।

तालिका से, सबसे कम प्रदूषण क्षमता वाला हाइड्रोकार्बन है:
ओकटाइन
हेक्सेन
बेंजीन
पैंटेन
संकल्प
वैकल्पिक डी
प्रश्न इंगित करता है कि प्रदूषण क्षमता को जारी ऊर्जा और CO. की मात्रा के बीच अनुपात (भागफल) के रूप में परिभाषित किया गया है2 इसके पूर्ण दहन में गठित। जितना बड़ा कारण, प्रदूषण क्षमता जितनी कम होती है, यानी CO. के प्रति मोल अधिक ऊर्जा निकलती है2 उत्पन्न।
की पूर्ण दहन प्रतिक्रियाएं हाइड्रोकार्बन उद्धृत हैं:
ओकटाइन: सी8एच18 +25/2 ओ2 → 8 सीओ2 + 9 घंटे2कारण: 5440/8 = 680
हेक्सेन: सी6एच14 +19/2 ओ2 → 6 सीओ2 + 7 घंटे2कारण: 4140/6 = 690
बेंजीन: सी6एच6 + 15/2 ओ2 → 6 सीओ2 + 3 एच2कारण: 3270/6 = 545
पैंटेन: सी5एच12 + 8 ओ2 → 5 सीओ2 + 6 एच2कारण: 3510/5 = 702
इस प्रकार, हम यह निष्कर्ष निकाल सकते हैं कि पेंटेन सबसे कम प्रदूषण क्षमता वाला हाइड्रोकार्बन है।
प्रश्न 2 - (एनेम 2015) वन अवशेषों का उपयोग हर दिन अधिक आकर्षक होता जा रहा है, क्योंकि वे ऊर्जा के नवीकरणीय स्रोत हैं। यह आंकड़ा लकड़ी के कचरे से निकाले गए जैव-तेल को जलाने का प्रतिनिधित्व करता है, जहां H1 इस जैव-तेल के 1 ग्राम के जलने से होने वाली एन्थैल्पी भिन्नता, जिसके परिणामस्वरूप कार्बन डाइऑक्साइड और तरल पानी, और H2 गैसीय अवस्था में 1 ग्राम पानी को तरल अवस्था में बदलने में शामिल एन्थैल्पी परिवर्तन।

इस जैव-तेल के 5 ग्राम को जलाने के लिए kJ में एन्थैल्पी भिन्नता, जिसके परिणामस्वरूप CO2 (गैसीय) और एच2(गैसीय) है:
ए) -106
बी) -94
सी) -82
डी) -21.2
ई) -16.4
संकल्प
वैकल्पिक सी
दिखाए गए ग्राफ से, हमारे पास H. है1 बायो-ऑयल बर्निंग उत्पादक CO. की एन्थैल्पी भिन्नता के रूप में2 (जी) और एच2ओ (1) और Δएच2 CO. के बाद से जल द्रवीकरण के एन्थैल्पी परिवर्तन के रूप में2 गैसीय रहता है और केवल की भौतिक अवस्था पानी परिवर्तन (गैस से तरल में)।
इस अभ्यास में 5 ग्राम जैव-तेल को जलाने के एन्थैल्पी परिवर्तन के लिए कहा जाता है, जिसके परिणामस्वरूप CO2 (गैसीय) और एच2ओ (गैसीय)। आरेख से, इस एन्थैल्पी परिवर्तन को ΔH = ΔH. के रूप में परिभाषित किया जा सकता है1 - एच2. इस प्रकार, H का मान -16.4 kJ/g के बराबर होगा। यह भिन्नता, जैसा कि हम इकाई में देख सकते हैं, जैव-तेल के प्रत्येक ग्राम के लिए है। 5 ग्राम के लिए हमें करना होगा अनुपात:
1 ग्राम जैव-तेल -16.4 kJ
5 ग्राम जैव तेल x
1. एक्स = 5. (-16,4)
एक्स = -82 केजे
फिर हम वैकल्पिक सी को चिह्नित कर सकते हैं।
स्टेफ़ानो अराउजो नोवाइसो द्वारा
रसायन विज्ञान शिक्षक

