परमाणु मॉडल परमाणुओं की संरचना की व्याख्या करने की आवश्यकता से उभरे हैं। जब परमाणुओं के गठन पर नए साक्ष्य प्रस्तुत किए गए, तो एक नए परमाणु मॉडल ने निष्कर्षों को स्पष्ट करने का प्रयास किया।
वी शताब्दी में यूनानी दार्शनिक डेमोक्रिटस और ल्यूसीपो; सी। परमाणु कहा जाता है, ग्रीक से ατoμoν, अविभाज्य कण और पदार्थ का सबसे छोटा भाग।
यद्यपि परमाणु की अवधारणा पुरानी है, परमाणु सिद्धांतों का विकास 19वीं और 20वीं शताब्दी में हुआ। इसलिए, पदार्थ की प्रकृति को समझने के लिए विकसित किए गए मुख्य परमाणु मॉडल थे:
- डाल्टन का परमाणु मॉडल (1803) - "बिलियर्ड बॉल मॉडल"
- थॉमसन परमाणु मॉडल (1898) - "रेन पुडिंग मॉडल"
- रदरफोर्ड का परमाणु मॉडल (1911) - "परमाणु मॉडल"
- बोहर का परमाणु मॉडल (1913) - "ग्रह मॉडल"
- क्वांटम परमाणु मॉडल (1926) - "इलेक्ट्रॉनिक क्लाउड मॉडल"

डाल्टन का परमाणु मॉडल
परमाणुओं का वर्णन करने का पहला मान्यता प्राप्त प्रयास अंग्रेजी वैज्ञानिक जॉन डाल्टन (1766-1844) ने एक मॉडल में किया, जिसे "बिलियर्ड बॉल" के रूप में जाना जाने लगा।
डाल्टन का परमाणु (1803): विशाल, अविभाज्य और अविनाशी क्षेत्र।

डाल्टन के अनुसार:
- सभी पदार्थ परमाणुओं से बनते हैं;
- एक रासायनिक तत्व के परमाणु आकार और विशेषताओं में समान होते हैं, जबकि विभिन्न रासायनिक तत्वों के परमाणु भिन्न होते हैं;
- पदार्थ एक रासायनिक प्रतिक्रिया का परिणाम होते हैं, जिसमें परमाणुओं का पुनर्संयोजन होता है।
नकारात्मक बिंदु: चूंकि डाल्टन ने अपना सिद्धांत तैयार करते समय इलेक्ट्रॉनों का अभी तक पता नहीं लगाया था, इसलिए इन कणों, जिन्हें अब हम परमाणुओं का हिस्सा जानते हैं, पर विचार नहीं किया गया था।
के बारे में अधिक जानने डाल्टन का परमाणु मॉडल.
थॉमसन परमाणु मॉडल
जोसेफ जॉन थॉमसन (1856-1940) इलेक्ट्रॉनों के अस्तित्व की खोज के लिए जिम्मेदार थे, कण एक नकारात्मक चार्ज के साथ संपन्न होते हैं और जो परमाणुओं का हिस्सा होते हैं। इस खोज ने डाल्टन के परमाणु सिद्धांत को उलट दिया, कि परमाणु अविभाज्य है, लेकिन छोटे कणों से भी बनता है और इसलिए, इसे "किशमिश का हलवा" के रूप में जाना जाने लगा।
थॉमसन का परमाणु (1898): निश्चित इलेक्ट्रॉनों के साथ सकारात्मक रूप से चार्ज किया गया गोला।

थॉमसन के अनुसार:
- परमाणु विद्युत रूप से तटस्थ है;
- इलेक्ट्रॉन खुद को एक सकारात्मक चार्ज सतह से जोड़ते हैं;
- परमाणुओं में वितरित इलेक्ट्रॉनों के बीच एक प्रतिकर्षण होता है।
नकारात्मक बिंदु: हालांकि थॉमसन ने इलेक्ट्रॉनों के अस्तित्व को ध्यान में रखा, परमाणु एक सकारात्मक क्षेत्र नहीं है, बल्कि इसके साथ संपन्न है सकारात्मक रूप से चार्ज किए गए कण, प्रोटॉन, 1886 में वैज्ञानिक यूजीन गोल्डस्टीन द्वारा पहचाने गए और बाद में अर्नेस्ट द्वारा पुष्टि की गई रदरफोर्ड।
के बारे में अधिक जानने थॉमसन परमाणु मॉडल.
रदरफोर्ड परमाणु मॉडल
अपने प्रयोगों के माध्यम से अर्नेस्ट रदरफोर्ड (1871-1937) ने यह प्रदर्शित करने में कामयाबी हासिल की कि परमाणु एक अविभाज्य कण नहीं था, जैसा कि माना जाता है, लेकिन यह छोटे कणों द्वारा बनाया गया था।
रदरफोर्ड का परमाणु (1911): धन आवेशित नाभिक और इलेक्ट्रॉन इसके चारों ओर इलेक्ट्रोस्फीयर में स्थित होते हैं।

रदरफोर्ड के अनुसार:
- परमाणु में एक केंद्रीय क्षेत्र होता है जिसमें धनात्मक आवेश की उच्च सांद्रता होती है;
- एक परमाणु का द्रव्यमान उसके मध्य क्षेत्र में केंद्रित होता है;
- इलेक्ट्रॉन हल्के होते हैं और नाभिक के चारों ओर स्थित होते हैं, एक ऐसा क्षेत्र जिसमें कई खाली स्थान होते हैं।
नकारात्मक बिंदु: परमाणु नाभिक में न केवल धनात्मक आवेशित कण होते हैं, बल्कि अन्य उप-परमाणु कण भी होते हैं, न्यूट्रॉन, 1932 में जेम्स चैडविक द्वारा खोजे गए थे। इसके अलावा, रदरफोर्ड द्वारा प्रस्तावित मॉडल ने परमाणुओं द्वारा प्रकाश के उत्सर्जन की व्याख्या नहीं की।
के बारे में अधिक जानने रदरफोर्ड परमाणु मॉडल.
बोहर का परमाणु मॉडल
यह समझाने की कोशिश करना कि तत्व कुछ स्थितियों के संपर्क में आने पर और उसके आधार पर विशिष्ट रंगों का उत्सर्जन क्यों करते हैं रदरफोर्ड के परमाणु मॉडल, नील्स बोहर (1885-1962) ने एक परमाणु सिद्धांत का प्रस्ताव रखा जिसने प्रकाश के उत्सर्जन को निश्चित रूप से समझाया आवृत्तियों।
बोहर का परमाणु (1913): इलेक्ट्रॉन नाभिक के चारों ओर स्थिर गोलाकार परतों में गति करते हैं।

बोहर के अनुसार:
- नाभिक के चारों ओर की परतों में इलेक्ट्रॉन गति करते हैं;
- कोर के चारों ओर की परतों में विशिष्ट ऊर्जा मान होते हैं;
- सबसे बाहरी स्तर पर जाने के लिए, इलेक्ट्रॉन को ऊर्जा को अवशोषित करना चाहिए। नाभिक के करीब एक परत पर लौटने पर, इलेक्ट्रॉन ऊर्जा छोड़ता है।
नकारात्मक बिंदु: यह नहीं कहा जा सकता है कि इलेक्ट्रॉन नाभिक के चारों ओर सूर्य के चारों ओर ग्रहों की तरह निश्चित स्थिति में यात्रा करते हैं।
के बारे में अधिक जानने बोहर परमाणु मॉडल.
क्वांटम परमाणु मॉडल
कई वैज्ञानिकों ने क्वांटम यांत्रिकी के विकास में योगदान दिया है, जो ए. की "अधिक वास्तविक" संरचना को समझाने की कोशिश करता है परमाणु कई अध्ययनों के संयोजन से और इसलिए, यह सबसे जटिल है।
क्वांटम परमाणु (1926): नाभिक प्रोटॉन (धनात्मक आवेश) और न्यूट्रॉन (शून्य आवेश) से बना होता है, और इलेक्ट्रॉन (ऋणात्मक आवेश) नाभिक के चारों ओर एक इलेक्ट्रॉनिक बादल बनाते हैं।

क्वांटम परमाणु मॉडल के अनुसार:
- नाभिक प्रोटॉन और न्यूट्रॉन से बना होता है। चूँकि केवल प्रोटॉन में ही आवेश होता है, नाभिक धनात्मक रूप से आवेशित होता है;
- इलेक्ट्रॉन नाभिक के चारों ओर एक इलेक्ट्रॉनिक बादल बनाते हैं;
- इलेक्ट्रॉन कक्षकों में, त्रि-आयामी अंतरिक्ष में गति करते हैं;
- एक इलेक्ट्रॉन की सटीक स्थिति को परिभाषित नहीं किया जा सकता है। क्या किया जाता है गणनाएं जो क्षेत्र की संभावना निर्धारित करती हैं कि एक निश्चित समय में एक इलेक्ट्रॉन होगा।
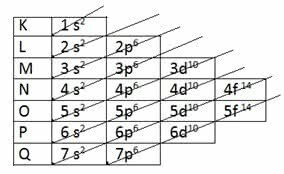
आप क्वांटम संख्याएं इलेक्ट्रॉनों का पता लगाने का कार्य है। क्या वो:
हे मुख्य क्वांटम संख्या (एन) ऊर्जा के स्तर, यानी परमाणु की इलेक्ट्रॉनिक परतों का प्रतिनिधित्व करता है।
हे माध्यमिक क्वांटम संख्या (एल) ऊर्जा उपस्तरों को इंगित करता है, यानी ऊर्जा उपस्तर जिससे इलेक्ट्रॉन संबंधित है।
हे चुंबकीय क्वांटम संख्या (एम) वह है जो उस कक्षा को इंगित करता है जहां इलेक्ट्रॉन मिलते हैं।
के बारे में अधिक जानने परमाणु मॉडल और के साथ अपने ज्ञान का परीक्षण करें test परमाणु मॉडल पर अभ्यास.